Diferencia entre enlaces saturados e insaturados
El diferencia clave entre enlaces saturados e insaturados es que Un enlace saturado no tiene enlaces PI, mientras que los enlaces insaturados siempre tienen enlaces PI.
Los enlaces químicos son los vínculos entre los átomos. Estos enlaces causan la formación de moléculas. Hay dos tipos principales de bonos; son los enlaces covalentes y los enlaces iónicos. Sin embargo, los enlaces en metales son enlaces metálicos. Los enlaces covalentes se forman cuando dos átomos comparten sus electrones de valencia. Estos enlaces covalentes se pueden saturar o insaturarse dependiendo del número y el tipo de enlace existente entre dos átomos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los enlaces saturados?
3. ¿Qué son los bonos insaturados?
4. Comparación de lado a lado: enlaces saturados vs insaturados en forma tabular
5. Resumen
¿Qué son los enlaces saturados??
Los enlaces saturados son enlaces únicos. Estos son enlaces químicos covalentes. Allí, dos átomos se unen entre sí a través de un enlace Sigma y, por lo tanto, no hay enlaces PI: las formas de enlace que involucran dos electrones; un electrón de cada uno de los dos átomos que forman este enlace. Estos electrones son los electrones de valencia de los átomos. La fuerza de enlace de este tipo de enlace es relativamente débil. Los dos electrones compartidos existen entre los átomos, y el átomo más electronegativo atraerá a los electrones hacia sí mismo.
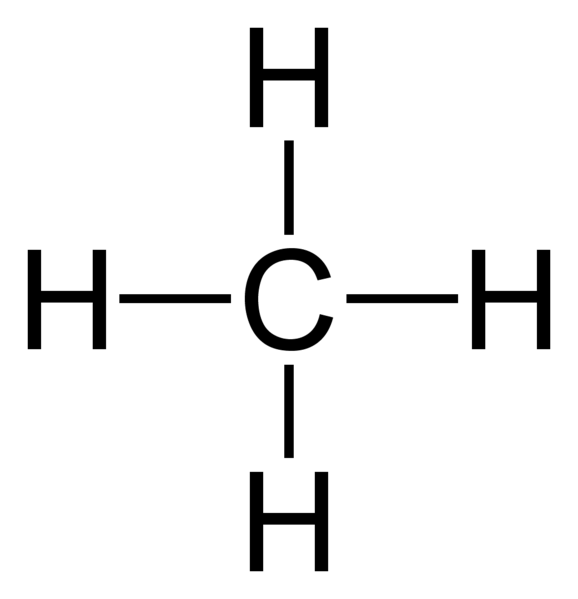
Figura 01: el metano es un compuesto saturado porque tiene cuatro enlaces saturados
Además, este tipo de enlace tiene la capacidad de someterse a rotaciones. Allí, este enlace actúa como el eje de rotación. Se forma un enlace saturado al seguir los orbitales se superponen entre sí.
- Dos orbitales
- Dos Pz orbitales
- S y Pz orbital
- Dos Dz2 orbitales
- Superposición lineal de orbitales híbridos.
¿Qué son los bonos insaturados??
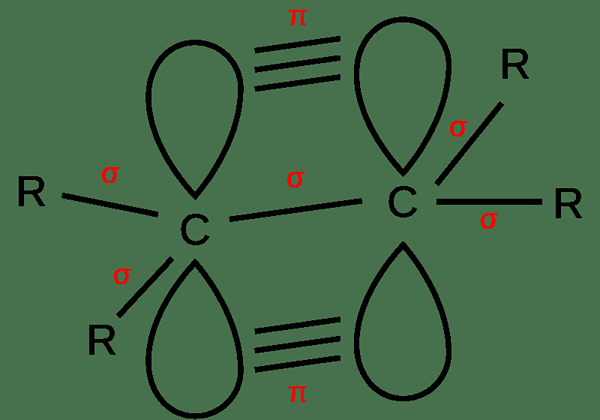
Los enlaces no saturados son enlaces dobles y triples enlaces entre dos átomos. Estos son enlaces covalentes. Por lo tanto, los electrones se comparten entre átomos. Además, también hay enlaces sigma y enlaces PI. En un doble enlace, hay un enlace sigma y un enlace PI entre dos átomos. En un triple enlace, hay un enlace Sigma y dos bonos PI. Se forma un enlace Sigma debido a la superposición lineal de los orbitales atómicos mientras se forman los enlaces PI debido a la superposición paralela.

Figura 02: Formación de un doble enlace
Además, un doble enlace tiene cuatro electrones de enlace entre los átomos, mientras que la unión triple tiene seis electrones allí. Debido a esta gran cantidad de electrones entre átomos en uniones insaturadas, estos enlaces tienden a ser más reactivos. Además, estos enlaces son más fuertes y más cortos en comparación con los enlaces individuales.
¿Cuál es la diferencia entre enlaces saturados e insaturados??
Los enlaces saturados son enlaces individuales, y los enlaces no saturados son enlaces dobles y triples enlaces entre dos átomos. La diferencia clave entre los enlaces saturados y insaturados es que un enlace saturado no tiene enlaces PI, mientras que los enlaces insaturados siempre tienen enlaces PI. Una diferencia adicional entre los enlaces saturados e insaturados es que hay un par de electrones entre dos átomos en un enlace saturado, mientras que hay dos o tres pares de electrones entre átomos en enlaces insaturados.
Además, una diferencia importante entre los enlaces saturados e insaturados es que los enlaces saturados son relativamente débiles, largos y menos reactivos, mientras que los enlaces insaturados son fuertes, cortos y más reactivos. Además, los enlaces saturados pueden sufrir rotaciones, mientras que los enlaces no saturados no pueden.
La siguiente infografía es un resumen de comparación sobre la diferencia entre los enlaces saturados y insaturados.
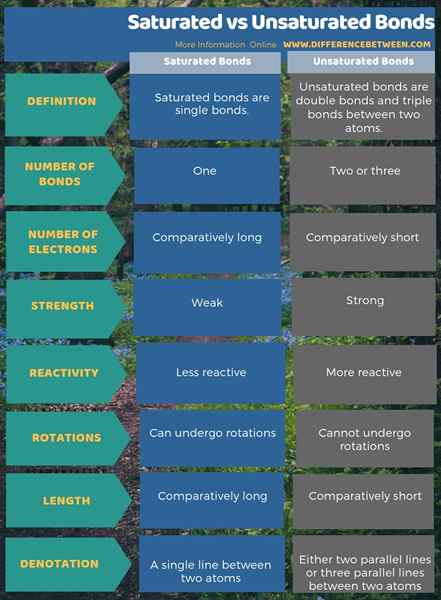
Resumen: enlaces saturados vs insaturados
En resumen, los enlaces saturados son enlaces covalentes únicos, mientras que los enlaces insaturados son enlaces dobles y triples. Por lo tanto, la diferencia clave entre los enlaces saturados y insaturados es que un enlace saturado no tiene enlaces PI, mientras que los enlaces insaturados siempre tienen enlaces PI.
Referencia:
1. Helmenstine, Anne Marie, PH.D. “Definición y ejemplos de doble enlace en química."Thinkco, sep. 8, 2017. Disponible aquí
2. Britannica, los editores de Encyclopedia. "Triple Bond."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 14 de abril. 2011. Disponible aquí
Imagen de cortesía:
1."Metano-2D-cuadrado" (dominio público) a través de Commons Wikimedia
2."Double-Bond" de Fred The Oysteri (CC By-Sa 4.0) a través de Commons Wikimedia


