Diferencia entre la página SDS y la página nativa

Diferencia de claves: página SDS vs nativa Página
SDS y Native Page son dos tipos de técnicas de electroforesis en gel de poliacrilamida utilizadas en biología molecular. El diferencia clave Entre la página SDS y la página nativa está el tipo de gel de poliacrilamida utilizado. En la página SDS se usa un gel desnaturalizante, por lo tanto, las moléculas se separan en función de su peso molecular. Por el contrario, en la página nativa, se utilizan geles que no denunciaban. Por lo tanto, las moléculas se separan en función de su tamaño, carga y forma.
Electroforesis en gel de poliacrilamida (PAGE) utiliza un gel hecho por monómeros de acrilamida polimerizantes con bisacrilamida de metileno. La poliacrilamida es más dura y más estable que agarosa. Los geles de poliacrilamida tienen un tamaño de poro más pequeño que permite la separación eficiente de las proteínas. Hay dos tipos principales de configuraciones de páginas, a saber, la página SDS y la página nativa. Página SDS o Electroforesis en gel de poliacrilamida de dodecil sulfato de sodio separa las proteínas en función de sus pesos moleculares. Los geles desnaturalizantes se utilizan en la página SDS. Página nativa utiliza geles no distenidos y separa proteínas en función de su tamaño, carga y la forma (conformación 3D).
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la página SDS?
3. ¿Qué es la página nativa?
4. Similitudes entre la página SDS y la página nativa
5. Comparación de lado a lado - página SDS vs nativa en forma tabular
6. Resumen
¿Qué es la página SDS??
La página SDS es la técnica electroforética más común utilizada para separar las proteínas según su peso molecular. El gel se realiza agregando SDS (dodecil sulfato de sodio), que es un detergente. SDS dentra proteínas en monómeros. SDS es un detergente aniónico. Por lo tanto, agrega una carga negativa neta a las proteínas dentro de un amplio rango de pH. Cuando la carga negativa neta se imparte en las moléculas de proteína, debido a la variación de carga, las estructuras complejas se descomponen. Debido a la carga negativa, las proteínas se atraen hacia el fin positivo. Por lo tanto, las moléculas con menor peso molecular viajan más rápido en la matriz de gel y se pueden observar cerca del ánodo, mientras que las proteínas de mayor peso molecular se observan más cerca de los pozos.
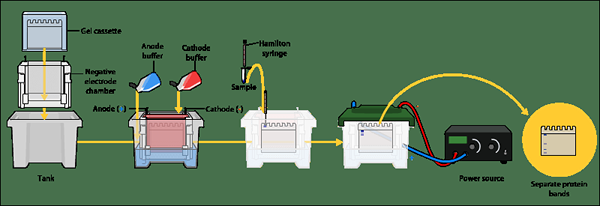
Figura 01: página SDS
La unión de SDS a la cadena de polipéptidos es proporcional a su masa molecular relativa. Por lo tanto, la masa molecular también se puede determinar a través de la página SDS. La tinción de los geles de la página SDS se realiza mediante tinción de azul de bromofenol. Aplicaciones del rango de página SDS en mayor medida donde se puede utilizar para estimar la masa molecular relativa y para determinar la abundancia relativa de proteínas en una mezcla de proteínas. La página SDS también se puede utilizar para determinar la distribución de proteínas en una mezcla de proteínas. La página SDS también se aplica para purificar y evaluar proteínas. Se utiliza como procedimiento preliminar para la transferencia Western e hibridación, que a su vez se usa para el mapeo e identificación de proteínas.
¿Qué es la página nativa??
Electroforesis de gel de poliacrilamida nativa (página nativa) utiliza un gel no desnaturalizante. Por lo tanto, SDS o cualquier otro agente desnaturalizante no se agrega a la matriz de gel. En la página nativa, la separación de proteínas se basa en la carga y el tamaño de la proteína. Por lo tanto, la movilidad de la proteína depende de la carga y el tamaño de la proteína.
La carga de la proteína depende de las cadenas laterales de los aminoácidos. Si las cadenas laterales se cargan negativamente, la proteína recibirá una carga negativa general y viceversa. Las proteínas conservan una conformación 3D debido al plegado que tiene lugar. Los resultados de plegado de los diversos tipos de enlaces en proteínas como enlaces disulfuro, interacciones hidrofóbicas y enlaces de hidrógeno. Por lo tanto, si la página nativa se transporta a un pH neutro, las proteínas se separarán de acuerdo con la forma molecular de la proteína. Por lo tanto, la página nativa puede usarse como una técnica sensible para detectar el cambio de carga o conformación de la proteína.
La principal ventaja de la página nativa es que la proteína utilizada para el análisis de la página se puede recuperar en su estado original después del análisis de la página, ya que la proteína no se altera durante el proceso. La página nativa es una técnica de rendimiento relativamente alta, y la estabilidad de la proteína aumenta.

Figura 02: página nativa
Al finalizar la ejecución de gel, el gel de página nativo se puede ver tinción con azul de bromofenol o cualquier otro reactivo de tinción adecuado. Las aplicaciones de la página nativa incluyen la separación de proteínas ácidas, incluidas las glucoproteínas como la eritropoyetina recombinante humana o la identificación de proteínas presentes en la albúmina de suero bovino (BSA).
¿Cuáles son las similitudes entre la página SDS y la página nativa??
- Tanto la página SDS como los sistemas de páginas nativas usan gel de poliacrilamida como la matriz del gel.
- Ambos se usan para la separación e identificación de proteínas.
- Ambos usan la movilidad electroforética para separar los compuestos.
- Ambos se pueden hacer de manera vertical u manera horizontal (principalmente realizadas como configuraciones de página verticales porque la longitud de ejecución es más).
- El aparato de electroforesis que incluye el tanque de gel, los peines, la fuente de alimentación es necesaria para el funcionamiento de ambas técnicas.
- La visualización del gel se puede hacer mediante la tinción de métodos en ambas técnicas.
¿Cuál es la diferencia entre la página SDS y la página nativa??
Página SDS vs Native Página | |
| Página SDS o la página de sodio-dodecil sulfato separan las proteínas en función de su peso molecular, y utiliza un gel desnaturalizante. | Página nativa utiliza geles no distenidos y separa proteínas en función de su tamaño, carga y la forma (conformación 3D). |
| Tipo de gel | |
| Se utiliza un gel desnaturalizante en SDS-PAGE. | Un gel no desnaturalizante se usa en la página nativa. |
| Presencia de SDS | |
| SDS está presente como detergente para impartir una carga negativa en la muestra en la página SDS. | SDS no está presente en la página nativa. |
| Base de separación | |
| La separación de proteínas depende del peso molecular de la proteína en la página SDS. | La separación depende del tamaño y la forma de la molécula de proteína en la página nativa. |
| Estabilidad de la proteína | |
| La estabilidad de la proteína es baja en la página SDS. | La estabilidad de la proteína es alta en la página nativa. |
| Recuperación de la proteína original | |
| No es posible, ya que se desnaturaliza en la página SDS. | Posible en la página nativa. |
Resumen - SDS Página vs nativa Página
La página SDS y la página nativa son dos tipos de técnicas de electroforesis en gel de poliacrilamida utilizadas para separar proteínas. La página SDS se trata con un detergente llamado SDS. SDS imparte una carga negativa general a la proteína, lo que resulta en la desnaturalización de la proteína. Por lo tanto, las proteínas se separan en función de su peso molecular. En contraste, la técnica de página nativa no utiliza ningún agente desnaturalizante. Por lo tanto, las proteínas se separan según su tamaño o la forma. Esta es la diferencia entre la página SDS y la página nativa.
Referencia:
1.“El principio y el método de la electroforesis en gel de poliacrilamida (SDS-PAGE)."El principio y el método de la electroforesis en gel de poliacrilamida (SDS-PAGE) | MBL Life Sience -Sia-. Disponible aquí
2."Geles nativos."Alliance Protein Laboratories | Servicios de caracterización biofísica. Disponible aquí
Imagen de cortesía:
1.'SDS-PAGE Electroforesis' por Bensaccount en English Wikipedia, (CC por 3.0) a través de Commons Wikimedia
2.'Cargue una muestra en una electroforesis de gel de poliacrilamida bien' por Blaz Nemec de Ljubljana, Eslovenia (CC By-SA 2.0) a través de Commons Wikimedia


