Diferencia entre el blindaje y el efecto de detección
Diferencia clave: protección vs Poner en pantalla Efecto
El efecto de blindaje es la reducción en la carga nuclear efectiva en la nube de electrones, debido a una diferencia en las fuerzas de atracción de los electrones en el núcleo. En otras palabras, es la reducción de la atracción entre el núcleo atómico y los electrones más externos debido a la presencia de electrones internos. El efecto de blindaje de los términos y el efecto de detección significan lo mismo. No hay diferencia entre el efecto de blindaje y el efecto de detección.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el efecto de blindaje?
3. ¿Qué es el efecto de detección?
4. Efecto de detección de protección contra
5. Resumen
¿Qué es el efecto de blindaje??
El efecto de blindaje es la reducción en la carga nuclear efectiva en la nube de electrones, debido a las diferencias en las fuerzas de atracción entre los electrones y el núcleo. Este término describe las fuerzas de atracción entre los electrones y el núcleo de un átomo que tiene más de un electrón. También se llama blindaje atómico.
El efecto de blindaje da la reducción de la atracción entre el núcleo atómico y los electrones más externos en un átomo que contiene muchos electrones. La carga nuclear efectiva es la carga positiva neta experimentada por los electrones en las cubiertas de electrones más exteriores de un átomo (electrones de valencia). Cuando hay muchos electrones de carcasa interna presentes, el núcleo atómico tiene menos atracción desde el núcleo atómico. Es porque el núcleo atómico está protegido por los electrones. Mayor el número de electrones internos, mayor el efecto de blindaje. El orden de aumentar el efecto de blindaje es el siguiente.
S Orbital> P Orbital> D Orbital> F Orbital
Hay tendencias periódicas de efecto de blindaje. Un átomo de hidrógeno es el átomo más pequeño en el que está presente un electrón. No hay electrones de blindaje, por lo tanto, la carga nuclear efectiva en este electrón no se reduce. Por lo tanto, no hay efecto de protección. Pero cuando se mueve a través de un período (de izquierda a derecha) en la tabla periódica, aumenta el número de electrones presentes en el átomo. Entonces el efecto de blindaje también aumenta.
La energía de ionización de los átomos está determinada principalmente por el efecto de blindaje. La energía de ionización es la cantidad de energía requerida para eliminar el electrón más externo de un átomo o un ion. Si el efecto de blindaje es alto, entonces el electrón más externo de ese átomo se siente menos atraído por el núcleo atómico, en otras palabras, los electrones más externos se eliminan fácilmente. Por lo tanto, mayor es el efecto de blindaje, menor la energía de ionización.

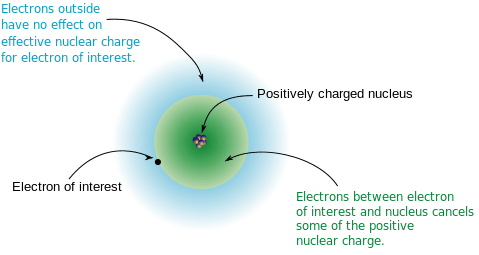
Figura 01: El efecto de blindaje en un electrón
Sin embargo, hay algunas excepciones de los valores de energía de ionización cuando se mueven en un período de la tabla periódica. Por ejemplo, la energía de ionización de Mg (magnesio) es mayor que la de Al (aluminio). Pero el número de electrones en AL es mayor que el de MG. Esto sucede porque el átomo de Al tiene el electrón más externo en un orbital 3p y este electrón no está apartado. Este electrón está protegido por dos electrones 3S. En mg, los electrones más externos son dos electrones 3S que se combinan en el mismo orbital. Por lo tanto, la carga nuclear efectiva en el electrón de valencia de Al es menor que la de Mg. Por lo tanto, es fácil ser eliminado del átomo de Al, lo que resulta en una menor energía de ionización en comparación con MG.
¿Qué es el efecto de detección??
El efecto de detección también se conoce como el efecto de blindaje. Es el efecto de la reducción de la atracción entre el núcleo atómico y los electrones más externos debido a la presencia de electrones de la carcasa interna. Que ocurre porque los electrones de la carcasa interna protegen el núcleo atómico.
¿Cuál es la diferencia entre el blindaje y el efecto de detección?
- El efecto de blindaje es la reducción en la carga nuclear efectiva en la nube de electrones, debido a las diferencias en las fuerzas de atracción entre los electrones y el núcleo. El efecto de blindaje también se conoce como efecto de detección. Por lo tanto, no hay diferencia entre estos dos términos. Principalmente significan lo mismo.
Resumen
El efecto de blindaje o el efecto de detección es la reducción de la atracción entre el núcleo atómico y los electrones más externos debido a la presencia de electrones de la carcasa interna. El efecto de blindaje provoca la reducción de la carga nuclear efectiva en un electrón. Los electrones de valencia se ven afectados por este efecto. No hay diferencia entre los términos efectos de blindaje y efecto de carga.
Referencia:
1."6.17: blindaje de electrones."Bibliotecas de química, Librettexts, 23 de agosto. 2017. Disponible aquí
2."Efecto de blindaje."Efecto de blindaje | Definición | Tendencia | Tutorvista. Disponible aquí
3."Efecto de blindaje."Wikipedia, Fundación Wikimedia, 5 Mar. 2018. Disponible aquí
Imagen de cortesía:
1.'Diagrama efectivo de carga nuclear' por Frozenman (dominio público) a través de Commons Wikimedia


