Diferencia entre el estado de singlete y triplete
El diferencia clave Entre el estado de la camiseta y el triplete es que el Singlet State muestra solo una línea espectral, mientras que Triplet State muestra una división triple de líneas espectrales.
Los términos estados singlete y triplete se discuten bajo la mecánica cuántica. Podemos describir estos términos con respecto al giro del sistema, yo.mi. átomo. En la mecánica cuántica, el giro no es una rotación mecánica. Es un concepto que caracteriza el momento angular de una partícula.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el estado singlete?
3. ¿Qué es el estado de triplete?
4. Comparación de lado a lado: estado singlete vs triplete en forma tabular
5. Resumen
¿Qué es el estado singlete??
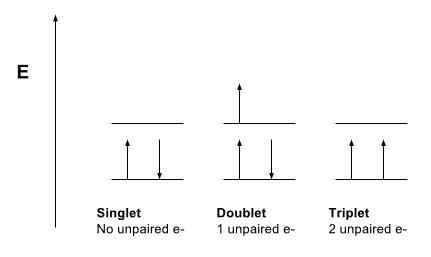
Un estado singlete se refiere a un sistema en el que todos los electrones están emparejados. El momento angular neto de las partículas en este tipo de sistema es cero. Por lo tanto, podemos decir que el número cuántico general de giro, S es cero (s = 0). Además, si tomamos el espectro de este sistema, muestra una línea espectral y, por lo tanto, obtuvo el nombre de "Estado singlete". Además, casi todas las moléculas que sabemos existen en el estado singlete, pero el oxígeno molecular es una excepción.

Figura 1: Comparación de singletes, doblete y los estados del triplete
Como ejemplo, el par de partículas unido más simple posible que tiene estado singlete es Positronium, que tiene un electrón y positrón. Estas dos partículas están unidas por su carga eléctrica opuesta. Además, los electrones emparejados de un sistema que tiene un estado singlete tiene orientaciones de giro paralelas.
¿Qué es el estado de triplete??
El estado triplete de un sistema describe que el sistema tiene dos electrones no apareados. El momento angular neto de las partículas en este tipo de sistema es 1. Por lo tanto, el número cuántico de giro es 1. Además, esto permite tres valores del momento angular como -1, 0 y +1. Por lo tanto, las líneas espectrales que obtenemos para este tipo de sistema se dividen en tres líneas y, por lo tanto, obtuvieron el nombre de Triplet State.
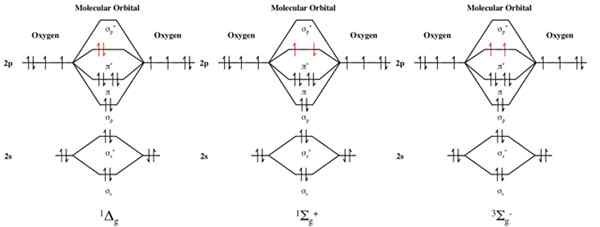
Se muestran tres configuraciones electrónicas de los orbitales moleculares del oxígeno molecular, O2. De izquierda a derecha, los diagramas son para el oxígeno de la camiseta de 1ΔG (primer estado excitado), 1σ+ g oxígeno del singlete (segundo estado excitado) y el oxígeno de triplete 3σ− g (estado fundamental).
Además, el mejor ejemplo de un estado de triplete es el oxígeno molecular. A temperatura ambiente, este oxígeno molecular da una división triple en las líneas espectrales.
¿Cuál es la diferencia entre el estado singlete y triplete??
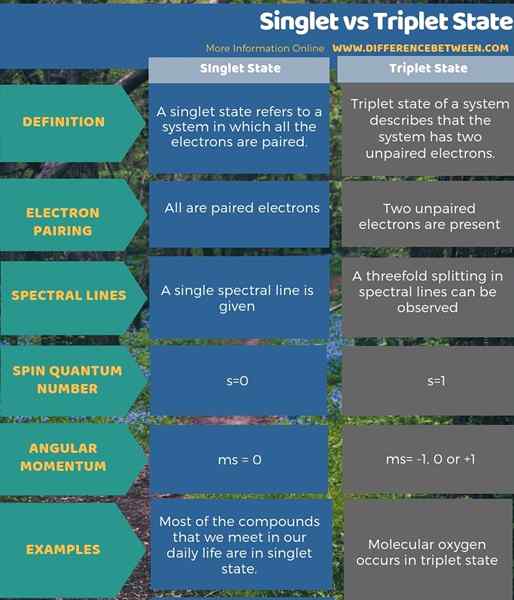
Un estado singlete se refiere a un sistema en el que todos los electrones están emparejados. Mientras que el estado triplete de un sistema describe que el sistema tiene dos electrones no apareados. La diferencia clave entre el estado de singlete y triplete es que el estado singlete muestra solo una línea espectral, mientras que el estado de triplete muestra la triple división de líneas espectrales.
Además, una diferencia adicional entre el estado singlete y triplete es que el número cuántico de giro de un estado singlete es s = 0, mientras que es s = 1 para un estado de triplete. Además, casi todas las moléculas que sabemos existen en estado singlete, excepto el oxígeno molecular. Mientras que, el oxígeno molecular ocurre en el estado de triplete.
A continuación, la información gráfica resume la diferencia entre el estado de singlete y triplete.
Resumen - Singlete vs Triplet State
Podemos discutir los términos estado singlete y estado de triplete como hechos sobre sistemas minuciosos como átomos. La diferencia clave entre el estado singlete y triplete es que el estado singlete muestra solo una línea espectral, mientras que el estado de triplete muestra la triple división de líneas espectrales.
Referencia:
- "Estado de triplete." Wikipedia, Fundación Wikimedia, 16 de febrero. 2019.
- "Estado singlete." Wikipedia, Fundación Wikimedia, 27 de diciembre. 2018.
Imagen de cortesía:
- "Diagrama de multiplicidad de spin" de Llightex - Trabajo propio, CC BY -SA 4.0, a través de Commons Wikimedia
- "Dos estados excitados singletes y estado fundamental del dioxígeno molecular" de Angelo Frei - Trabajo propio, CC By -Sa 3.0, a través de Commons Wikimedia


