Diferencia entre SiO2 y CO2

El diferencia clave entre SiO2 y CO2 es que El SIO2 existe en fase sólida, mientras que el CO2 existe en fase gaseosa en condiciones de temperatura y presión estándar.
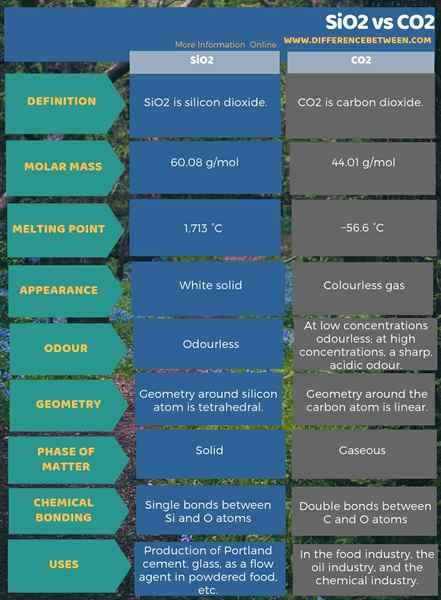
SiO2 es dióxido de silicio. El CO2 es dióxido de carbono. Tanto el silicio como el carbono son elementos del grupo 14 en la tabla periódica de elementos. Estos dos óxidos son los óxidos más comunes y estables que forman. Sin embargo, hay muchas diferencias entre SiO2 y CO2. La diferencia clave entre SIO2 y CO2 es la fase en la que existen a temperatura y presión estándar.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es siO2
3. ¿Qué es CO2?
4. Comparación de lado a lado - SIO2 vs CO2 en forma tabular
5. Resumen
Que es siO2?
SiO2 es dióxido de silicio. Es el óxido de silicio más común y estable. Este compuesto existe en la fase sólida en condiciones de temperatura y presión estándar. Podemos encontrarlo en la naturaleza como cuarzo. Existe como el principal constituyente de la arena. La masa molar de este compuesto es de 60.08 g/mol. Aparece como un sólido blanco. Los puntos de fusión y ebullición son 1.713 ° C y 2,950 ° C respectivamente.

Figura 01: Muestra de dióxido de silicio
Aunque el átomo de silicio tiene solo dos átomos de oxígeno unidos, se dice que la geometría alrededor del átomo de silicio es tetraédrica. Esto se debe a que este compuesto existe como una sustancia polimérica que tiene unidades de repetición SIO4. Hay muchos usos de este compuesto. Tiene solicitudes para fines de construcción, yo.mi. Producción de cemento de Portland. Además, es el ingrediente principal en la producción de vidrio. Además, SIO2 es útil en aplicaciones alimentarias y farmacéuticas también, yo.mi. Como agente de flujo en alimentos en polvo.
¿Qué es CO2??
El CO2 es dióxido de carbono, y es el óxido de carbono más común y estable. Existe en la fase gaseosa en condiciones de temperatura y presión estándar. El CO2 ocurre naturalmente como gas de dióxido de carbono en la atmósfera (aproximadamente 0.03%). Es un gas incoloro con una densidad que es más alta que el aire seco. La masa molar es 44.01 g/mol. A bajas concentraciones es inodoro, pero a alta concentración, tiene un olor agudo y ácido. El punto de fusión del CO2 es −56.6 ° C.

Figura 02: Burbujas de dióxido de carbono en un refresco
Esta molécula tiene una estructura lineal. Los dos átomos de oxígeno se unen con el átomo de carbono a través de dobles enlaces en lados opuestos. La molécula no tiene dipolo eléctrico porque es simétrico. Además, este compuesto es soluble en agua; Forma el ácido carbónico débil. Casi todos los organismos aeróbicos producen este gas en su respiración. Tiene muchos usos en la industria alimentaria, la industria petrolera y la industria química. Por ejemplo, es un precursor de muchos otros productos químicos como el metanol. Además, es un aditivo alimentario, y lo usamos para la producción de refrescos carbonatados. Aparte de eso, podemos usar dióxido de carbono para extinguir llamas.
¿Cuál es la diferencia entre SIO2 y CO2??
SiO2 es dióxido de silicio, y el CO2 es dióxido de carbono. La diferencia clave entre SIO2 y CO2 es que el SIO2 existe en la fase sólida, mientras que el CO2 existe en la fase gaseosa en condiciones de temperatura y presión estándar. Además, el dióxido de silicio tiene un color blanco, mientras que el dióxido de carbono es un compuesto incoloro.
Una diferencia importante entre SiO2 y CO2 es que el SiO2 tiene la geometría tetraédrica alrededor del átomo de silicio, mientras que el CO2 tiene la geometría lineal alrededor del átomo de carbono. Una diferencia adicional entre SIO2 y CO2 es que el SIO2 tiene enlaces únicos entre los átomos de Si y O, mientras que el CO2 tiene dobles enlaces entre los átomos de C y O.
Resumen -SiO2 vs CO2
Tanto el silicio (Si) como el carbono (c) son elementos del grupo 14 en la tabla periódica. Además, los óxidos más comunes de estos elementos son SiO2 y CO2. La diferencia clave entre SIO2 y CO2 es que el SIO2 existe en la fase sólida, mientras que el CO2 existe en la fase gaseosa en condiciones de temperatura y presión estándar.
Referencia:
1. Britannica, los editores de Encyclopedia. "Dióxido de carbono."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 de enero. 2018. Disponible aquí
2. "Dióxido de silicio."Wikipedia, Fundación Wikimedia, 19 de noviembre. 2018. Disponible aquí
Imagen de cortesía:
1."Muestra de dióxido de silicio" por LHCHEM - Trabajo propio, (CC BY -SA 3.0) a través de Commons Wikimedia
2."Macro de burbujas de soda" de Spiff (dominio público) a través de Commons Wikimedia


