Diferencia entre clorito de sodio e hipoclorito de sodio

Diferencia clave: clorito de sodio frente a hipoclorito de sodio
El clorito de sodio y el hipoclorito de sodio son sales de sodio comunes utilizadas en las industrias. Ambos compuestos son muy importantes como agentes de blanqueo y desinfectantes. Pero son muy diferentes entre sí cuando se consideran sus propiedades químicas como la masa molar y las propiedades físicas. El clorito de sodio se usa principalmente en la fabricación de papel y como desinfectante. El hipoclorito de sodio se usa como desinfectante al disolverlo en agua para formar "blanqueador líquido". La diferencia clave entre el clorito de sodio y el hipoclorito de sodio es que El clorito de sodio contiene átomos de cloro que tienen +3 estado de oxidación mientras que el hipoclorito de sodio contiene átomos de cloro que tienen un estado de oxidación +1.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el clorito de sodio?
3. ¿Qué es el hipoclorito de sodio?
4. Similitudes entre clorito de sodio e hipoclorito de sodio
5. Comparación de lado a lado: clorito de sodio frente a hipoclorito de sodio en forma tabular
6. Resumen
¿Qué es el clorito de sodio??
El clorito de sodio es un compuesto químico inorgánico que tiene la fórmula química Naclo2. La masa molar de este compuesto es 90.438 g/mol cuando es anhidro. También hay una forma de hidrato (compuesta por tres moléculas de agua asociadas con la molécula de clorito de sodio cuya masa molar es 144.48 g/mol). El compuesto también se llama ácido clorous. Es un compuesto iónico que contiene un catión de sodio (NA+) y anión de clorito (clo2-).

Figura 1: una botella llena de clorito de sodio
Está disponible como un polvo cristalino blanco que es inodoro. La quema de clorito de sodio es difícil, pero puede acelerar la quema de compuestos orgánicos. Por lo tanto, el clorito de sodio se puede usar para hacer mezclas explosivas con materiales combustibles. El clorito de sodio se descompone a aproximadamente 180-200 ° C.
El clorito de sodio es menos soluble en agua pero más soluble en metanol y etanol. La estructura cristalina del compuesto es monoclínica. El clorito de sodio se usa principalmente en la fabricación de papel y también como desinfectante. Es un buen agente oxidante; Por lo tanto, se usa para blanquear varios tipos de materiales, como madera, aceites, etc.
El ácido clorous libre (HCLO2) es muy inestable y no tiene una importancia considerable en las industrias. Pero la sal de sodio de este ácido es muy estable y también económica. La mayoría de las veces, el clorito de sodio se deriva del clorato de sodio, que tiene la fórmula química Naclo3. El proceso de producción es un método indirecto en el que el dióxido de cloro (CLO2) se produce al principio. El dióxido de cloro es muy explosivo y se realiza al reducir el clorato de sodio en un ácido fuerte en presencia de un agente reductor como el sulfito de sodio. El dióxido de cloro producido se absorbe a una solución alcalina junto con la reducción por peróxido de hidrógeno (H2O2). Esto produce clorito de sodio.
¿Qué es el hipoclorito de sodio??
El hipoclorito de sodio es un compuesto inorgánico que tiene la fórmula química Naclo. La relación atómica entre sodio, cloro y oxígeno es 1: 1: 1. El compuesto está compuesto por un catión de sodio unido a un anión hipoclorito. Por lo tanto, es la sal de sodio del ácido hipocloro. Cuando el hipoclorito de sodio se disuelve en agua, se conoce como blanqueador líquido debido a sus propiedades de blanqueo.
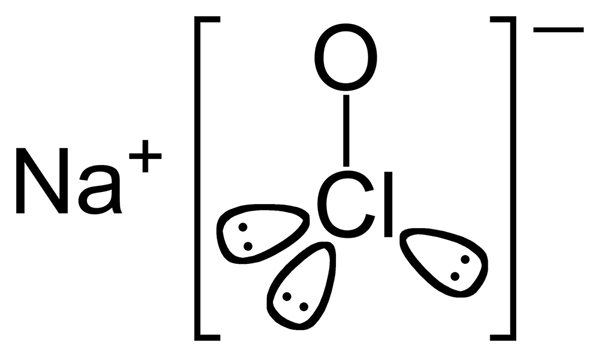
Figura 2: Estructura química del hipoclorito de sodio
La masa molar de hipoclorito de sodio es 74.44 g/mol. La apariencia de este compuesto puede describirse como un sólido amarillo verdoso. También tiene un olor dulce. El punto de fusión del hipoclorito de sodio es de 18 ° C y el punto de ebullición es de 101 ° C.
El hipoclorito de sodio se usa principalmente como desinfectante y como agente blanqueador. Casi todo el líquido de blanqueo que usamos en el hogar contiene alrededor del 3-8% de hipoclorito de sodio. Este compuesto tiene propiedades de tinción; Por lo tanto, se usa para eliminar manchas de moho, manchas dentales, etc. El hipoclorito de sodio es un buen desinfectante ya que tiene una amplia gama de actividad antimicrobiana.
La producción de hipoclorito de sodio se realiza a través del proceso de Hooker. Es un método industrial a gran escala. Aquí, el hipoclorito de sodio se produce pasando el gas de cloro a una solución fría y diluida de hidróxido de sodio. El otro producto que está dado por este método es el cloruro de sodio (NaCl).
¿Cuáles son las similitudes entre el clorito de sodio y el hipoclorito de sodio??
- El clorito de sodio y el hipoclorito de sodio están compuestos de átomos de Na, CL y O.
- Ambos son buenos desinfectantes.
¿Cuál es la diferencia entre el clorito de sodio y el hipoclorito de sodio??
Clorito de sodio vs hipoclorito de sodio | |
| El clorito de sodio es un compuesto químico inorgánico que tiene la fórmula química Naclo2. | El hipoclorito de sodio es un compuesto inorgánico que tiene la fórmula química Naclo. |
| Atomicidad | |
| El clorito de sodio tiene un átomo de sodio, un átomo de cloro y dos átomos de oxígeno. | El hipoclorito de sodio tiene un átomo de sodio, átomo de cloro y átomo de oxígeno. |
| Estado de oxidación de cloro | |
| El estado de oxidación del cloro en el clorito de sodio es +3. | El estado de oxidación del cloro en el hipoclorito de sodio es +1. |
| Apariencia | |
| El clorito de sodio es un polvo cristalino blanco. | El hipoclorito de sodio es un sólido de color amarillo verdoso. |
| Olor | |
| El clorito de sodio es inodoro. | El hipoclorito de sodio tiene un olor dulce. |
| Masa molar | |
| La masa molar de clorito de sodio es 90.438 g/mol. | La masa molar de hipoclorito de sodio es 74.44 g/mol. |
| Punto de fusión y punto de ebullición | |
| El clorito de sodio se descompone a aproximadamente 180-200 ° C. | El punto de fusión es de 18 ° C y el punto de ebullición es de 101 ° C. |
| Compuesto original | |
| El clorito de sodio es una sal de sodio de ácido cloro. | El hipoclorito de sodio es una sal de sodio de ácido hipocloro. |
| Producción | |
| El clorito de sodio se produce indirectamente a partir de clorato de sodio. | El hipoclorito de sodio se produce a partir del proceso de Hooker. |
Resumen -clorito de sodio frente a hipoclorito de sodio
El clorito de sodio es Naclo2 y el hipoclorito de sodio es Naclo. La diferencia clave entre el clorito de sodio y el hipoclorito de sodio es que el clorito de sodio contiene átomos de cloro que tienen un estado de oxidaciones de +3, mientras que el hipoclorito de sodio contiene átomos de cloro que tiene un estado de oxidaciones de +1.
Referencia:
1. "Hipoclorito de sodio."Centro Nacional de Información de Biotecnología. Base de datos de compuestos de pubChem, u.S. Biblioteca Nacional de Medicina, disponible aquí.
2. Croswell, Jonathan. "¿Qué es el clorito de sodio??"Livestrong.Com, grupo de hoja, 3 de octubre. 2017, disponible aquí.
3. "Hipoclorito de sodio."Wikipedia, Fundación Wikimedia, 17 de febrero. 2018, disponible aquí.
Imagen de cortesía:
1. "Sodio Clorito 450g" por W. Oelen -(CC BY -SA 3.0) a través de Commons Wikimedia
2. "Sodio-Hipoclorito" de Benjah-BMM27-Trabajo propio (dominio público) a través de Commons Wikimedia


