Diferencia entre el fluoruro de sodio y el fluoruro de calcio

Diferencia clave: fluoruro de sodio vs fluoruro de calcio
El fluoruro de sodio y el fluoruro de calcio son dos minerales de fluoruro de los elementos en el grupo I y el grupo II de la tabla periódica. Si bien existen naturalmente en forma de minerales, también se producen comercialmente para aplicaciones industriales. Pero, La forma natural de fluoruro de sodio es relativamente rara, y el fluoruro de calcio es muy abundante. Esto puede considerarse el diferencia clave entre el fluoruro de sodio y el fluoruro de calcio. Aunque ambos son fluoruros que contienen sólidos cristalinos, sus aplicaciones industriales varían ampliamente; se utilizan para diversos fines.
¿Qué es el fluoruro de sodio??
El fluoruro de sodio es un compuesto químico iónico incoloro e inorgánico con la fórmula molecular NAF. Como el cloruro de sodio, se disuelve en agua dando na+ y F- por separado.
NAF (s) → N / A+ (aq) +F- (aq)
El fluoruro de sodio existe naturalmente como un mineral llamado 'villiaumita', que es relativamente raro y se puede encontrar en rocas syenite de la nefelina plutónica.
El cloruro de sodio es una de las fuentes de iones de fluoruro más utilizadas en muchas aplicaciones industriales, ya que es menos costoso y menos compuesto higroscópico que el fluoruro de potasio (KF).

Villiamumita
¿Qué es el fluoruro de calcio??
El fluoruro de calcio es un compuesto sólido químico iónico e inorgánico blanco, inorgánico, con el CAF de fórmula molecular2. También se conoce como fluorspar, y naturalmente existe como fluorita mineral y posee una coloración profunda debido a sus impurezas. El mineral de fluorita se puede encontrar en muchos lugares, y se usa como precursor de HF. Pero, algunos procesos industriales requieren floruro de calcio puro, sin impurezas. Por lo tanto, CAF de alta pureza2 se produce industrialmente mediante el uso de carbonato de calcio y fluoruro de hidrógeno.
Caco3 + 2 HF → CAF2 + CO2 + H2O

Fluoruro de calcio
¿Cuál es la diferencia entre el fluoruro de sodio y el fluoruro de calcio??
Estructura química del fluoruro de sodio y fluoruro de calcio
Fluoruro de sodio:
El fluoruro de sodio es un cristal iónico que cristaliza en un motivo cúbico. En su estructura, ambos na+ y F- Contiene sitios de coordinación octaédrica, y su espaciado en red es aproximadamente igual a 462 pm. Esta longitud es bastante menor que la del cloruro de sodio.
Fluoruro de calcio:
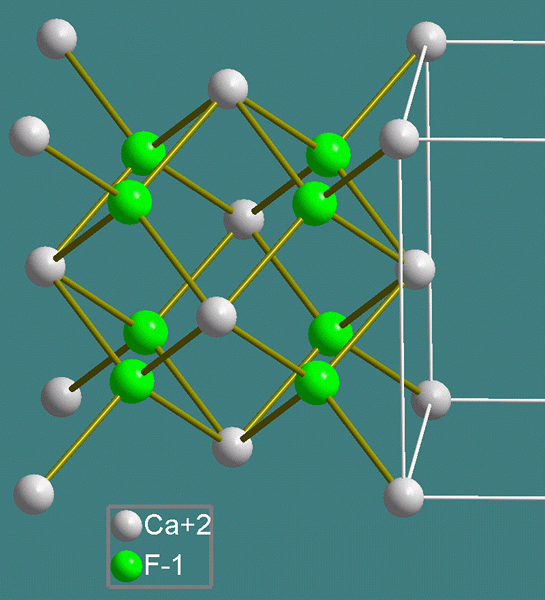
El fluoruro de calcio existe naturalmente en forma de fluorita y cristaliza un motivo cúbico. California2+ sirve como centros de ocho coordinados y se encuentra en una caja para ocho F- centros. Cada F- El centro está coordinado a cuatro CA2+ centros. En general, los cristales perfectamente empaquetados son incoloros, pero el mineral posee un color profundo debido a los centros F.
La estructura de una celda unitaria de CAF2 (fluorita) se muestra a continuación.
Usos de fluoruro de sodio y fluoruro de calcio
Fluoruro de sodio:
El fluoruro de sodio se utiliza ampliamente en una amplia gama de aplicaciones industriales, incluida la industria médica y química. En aplicaciones médicas, se utiliza en imágenes médicas y en el tratamiento de la osteoporosis. En la industria química, se utiliza en los procesos de síntesis y extracción en metalurgia, como agente de limpieza y como veneno estomacal para insectos de alimentación de plantas.
También se usa en el tratamiento de agua. Se agrega al agua potable en la fluoridad del agua para aumentar el nivel de fluoruro en el agua. En algunos países, se agrega a algunos productos alimenticios.
Fluoruro de calcio:
Ambos CAF naturales y producidos comercialmente2 son igualmente importantes en muchas aplicaciones industriales. Está naturalmente presente en el mineral de fluorita, y es la fuente principal de proceso de fabricación de fluoruro de hidrógeno. La reacción entre el mineral de fluorita y el ácido sulfúrico concentrado produce fluoruro de hidrógeno.
C y f2 + Concepto2ENTONCES4 → CASO4 (sólido)+ 2 HF
Además, se utiliza para producir componentes ópticos debido a sus propiedades especiales. Es transparente en una amplia gama de frecuencias; de ultravioleta (UV) a infrarrojo (IR), bajo índice de refracción y la insolubilidad en el agua. Se utiliza para fabricar ventanas y lentes utilizados en sistemas de imágenes térmicas, espectroscopía y láser Excimer.
Imagen de cortesía: "Villiamumita en el flúor de sodio syenite de nefasos ..." por Dave Dyet - Shutterstone.com, dyet.Com - trabajo propio (dominio público) a través de Commons Wikimedia "Florida de calcio" (dominio público) a través de Commons wikimedia "Florida de sodio" de Benjah -BMM27 - Trabajo propio (dominio público) a través de Commons Wikimedia "Estructura cristalina de fluorita" por material de científico en Wikipedia en inglés (CC By-SA 3.0) a través de Commons Wikimedia

