Diferencia entre el nitrato de sodio y el nitrito de sodio

El diferencia clave entre el nitrato de sodio y el nitrito de sodio es que El nitrato de sodio aparece como cristales incoloros, mientras que el nitrito de sodio aparece como cristales amarillentos.
Tanto el nitrato de sodio como el nitrito de sodio son compuestos iónicos de elementos químicos de sodio, nitrógeno y oxígeno. Estos dos compuestos difieren entre sí según el anión presente junto con el catión de sodio.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el nitrato de sodio?
3. ¿Qué es el nitrito de sodio?
4. Comparación de lado a lado: nitrato de sodio frente a nitrito de sodio en forma tabular
5. Resumen
¿Qué es el nitrato de sodio??
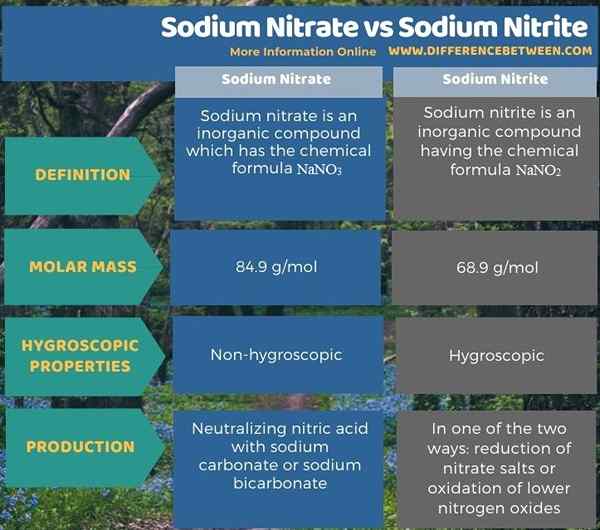
El nitrato de sodio es un compuesto inorgánico que tiene la fórmula química nano3. Aparece como un sólido cristalino sin color blanco. Es una sal de nitrato de metal alcalino, que se llama salador de chile en mineralogía. Este compuesto es altamente soluble en agua. Tras la disolución, forma cationes de sodio y aniones de nitrato. Por lo tanto, es útil como una fuente disponible fácilmente en diferentes procesos de síntesis, producción de fertilizantes, etc.

Figura 01: nitrato de sodio
La masa molar de nitrato de sodio es 84.9 g/mol. Tiene un olor dulce. Además de la minería de los depósitos, también podemos síntesis de nitrato de sodio en el laboratorio. Allí, podemos neutralizar el ácido nítrico con carbonato de sodio o bicarbonato de sodio. También es posible hacer esta neutralización usando hidróxido de sodio. La estructura cristalina de este nitrato de sodio producido se puede definir como una estructura cristalina trigonal, pero a veces proporciona una estructura cristalina romboédrica.
¿Qué es el nitrito de sodio??
El nitrito de sodio es un compuesto inorgánico que tiene la fórmula química nano2. Tiene una apariencia cristalina blanca amarilla. Este compuesto también es altamente soluble en agua e higroscópica. La masa molar de este compuesto 68.9 g/mol. Además, la estructura cristalina del nitrito de sodio es ortorrómbico. La producción industrial de nitrito de sodio se puede hacer de dos maneras: reducción de sales de nitrato o oxidación de óxidos de nitrógeno más bajos.

Figura 02: nitrito de sodio
El uso principal de nitrito de sodio en la industria es producir compuestos de organonitrógeno. Allí, podemos usarlo como reactivo para la conversión de aminas en compuestos de diazo. Estos compuestos de diazo son la clave para muchos compuestos azo como tintes. Además, el nitrito de sodio es un medicamento eficiente en el envenenamiento por cianuro. También es un aditivo alimentario importante porque la adición de nitrito de sodio es una manera fácil de darle a la carne procesada un color rosa sombreado. El sabor de la carne también se ve reforzado por este compuesto. Sin embargo, el nitrito de sodio ha sido reconocido como un compuesto ligeramente tóxico.
¿Cuál es la diferencia entre el nitrato de sodio y el nitrito de sodio??
Tanto el nitrato de sodio como el nitrito de sodio son compuestos iónicos de elementos químicos de sodio, nitrógeno y oxígeno. La diferencia clave entre el nitrato de sodio y el nitrito de sodio es que el nitrato de sodio aparece como cristales incoloros, mientras que el nitrito de sodio aparece como cristales amarillentos. El anión en el nitrato de sodio no es3- y en el nitrito de sodio no es2-. Ambos compuestos son solubles en agua, pero el nitrito de sodio también es higroscópico.
Además, la estructura cristalina del nitrato de sodio es trigonal, mientras que la estructura cristalina del nitrito de sodio es ortorrómbico. Podemos producir nitrato de sodio mediante ácido nítrico neutralizante con carbonato de sodio o bicarbonato de sodio. Podemos producir nitrito de sodio de una de las dos maneras: reducción de sales de nitrato o oxidación de óxidos de nitrógeno más bajos.
Debajo de la infografía resume la diferencia entre el nitrato de sodio y el nitrito de sodio.
Resumen -nitrato de sodio vs nitrito de sodio
Tanto el nitrato de sodio como el nitrito de sodio son compuestos iónicos de elementos químicos de sodio, nitrógeno y oxígeno. La diferencia clave entre el nitrato de sodio y el nitrito de sodio es que el nitrato de sodio aparece como cristales incoloros, mientras que el nitrito de sodio aparece como cristales amarillentos.
Referencia:
1. Helmenstine, Anne Marie. "Cómo cultivar cristales de nitrato de sodio."Thinkco, Mar. 26, 2019, disponible aquí.
Imagen de cortesía:
1. "Dusičnan Sodný" de Ondřej mangl - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Cristales de nitrito de sodio" de W. Oelen - (CC BY -SA 3.0) a través de Commons Wikimedia


