Diferencia entre sales solubles e insoluble

El diferencia clave Entre sales soluble e insoluble es que Las sales solubles pueden disolverse en agua a temperatura ambiente, mientras que las sales insolubles no pueden disolverse en agua a temperatura ambiente.
Una sal es cualquier compuesto formado a partir de la reacción entre un ácido y una base. Por lo tanto, una sal esencialmente contiene un anión (proviene del ácido) y un catión (proviene de la base). Podemos dividir los compuestos de sal en dos tipos dependiendo de su solubilidad en el agua a temperatura ambiente. Son sales solubles e insolubles. La solubilidad de las sales depende de los tipos de interacciones que pueden tener con las moléculas de agua.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las sales solubles?
3. ¿Qué son las sales insolubles?
4. Comparación lado a lado: sales soluble vs insoluble en forma tabular
5. Resumen
¿Qué son las sales solubles??
Las sales solubles son compuestos de sal que son solubles en agua a temperatura ambiente. Estos compuestos de sal se disuelven en agua porque pueden formar atracciones intermoleculares con moléculas de agua. Las moléculas de agua son polares. Por lo tanto, el agua es un disolvente polar, y las sales polares pueden disolverse en agua.

Figura 01: el cloruro de sodio es una sal soluble
Dado que las sales son compuestos iónicos, se disuelven en agua porque las moléculas de agua tienden a atraer los iones en el compuesto, lo que los hace separados entre sí, lo que resulta en la disolución de la sal. Aquí, la disolución de la sal forma especies iónicas en el agua, lo que hace que la solución acuosa recién formada sea altamente conductora. Las especies iónicas disueltas en el agua pueden llevar a la electricidad a través de ella. Un ejemplo de sal soluble es la sal de mesa o el cloruro de sodio. Una solución acuosa de sal de mesa contiene iones de sodio e iones de cloruro.
¿Qué son las sales insolubles??
Las sales insolubles son compuestos de sal que son insolubles en agua a temperatura ambiente. Estos son insolubles en agua porque las moléculas de agua no pueden atraer los iones en el compuesto de sal. Por lo tanto, no hay interacciones intermoleculares entre las moléculas de agua y los compuestos de sal insolubles.

Figura 02: Precipitado de cloruro de plata en el agua
Además, las sales insolubles son compuestos no polares. A diferencia de las sales solubles, la mezcla de sales insolubles con agua no hace que la solución sea conductora porque la sal no se separa en los iones. Un buen ejemplo de sal insoluble es el cloruro de plata (AGCL).
¿Cuál es la diferencia entre sales soluble e insoluble??
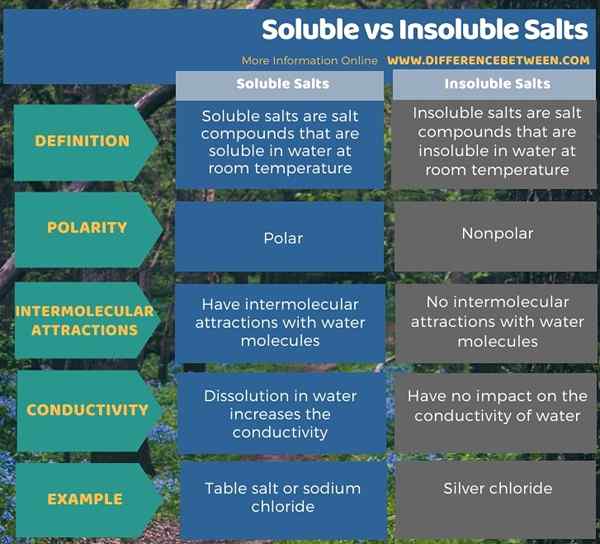
Podemos dividir los compuestos de sal en dos tipos dependiendo de su solubilidad en el agua. Son sales solubles e insolubles. La diferencia clave entre las sales solubles e insolubles es que las sales solubles pueden disolverse en agua a temperatura ambiente, mientras que las sales insolubles no pueden disolverse a temperatura ambiente a temperatura ambiente. Además, las sales solubles son polares; Por eso pueden disolverse en agua, que es un solvente polar. En contraste, las sales insolubles no son polares. Entonces, esta es otra diferencia significativa entre sales solubles e insolubles.
Además de lo anterior, las moléculas de agua pueden formar atracciones intermoleculares con los iones de sales solubles, pero no hay interacciones intermoleculares entre sales insolubles y agua. Además, la disolución de sales solubles en el agua hace una solución acuosa altamente conductiva porque los iones disueltos en el agua pueden conducir electricidad a través de ella. A diferencia de las sales solubles, la mezcla de sales insolubles con agua no hace que el agua sea conductora. El cloruro de sodio es un ejemplo de sales solubles, mientras que el cloruro de plata es un ejemplo de sal insoluble.
Resumen -Salas soluble vs insoluble
Podemos dividir los compuestos de sal en dos tipos dependiendo de su solubilidad en el agua. Son sales solubles e insolubles. La diferencia clave entre las sales solubles e insolubles es que las sales solubles pueden disolverse en agua a temperatura ambiente, mientras que las sales insolubles no pueden disolverse en agua a temperatura ambiente. Además, las sales solubles son polares; Por eso pueden disolverse en agua, que es un solvente polar. En contraste, las sales insolubles no son polares.
Referencia:
1. "Salas insolubles."Bibliotecas de química, Librettexts, 5 de junio de 2019, disponible aquí.
2. "Definición de sales insolubles (precipitados)."Diccionario Cehmicool, disponible aquí.
3. "Salas insolubles."Salts-Tripod, disponible aquí.
Imagen de cortesía:
1. "Cloruro de sodio" por ChemicalInterest - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Cloruro de plata (AGCL)" de Luisbrudna - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia


