Diferencia entre la energía de solvatación y la energía de la red
Diferencia clave: energía de solvatación VS Energía reticular
La energía de la solvatación es el cambio en la energía de Gibbs de un solvente cuando un soluto se disuelve en ese solvente. La energía de la red es la cantidad de energía liberada durante la formación de una red de los iones o la cantidad de energía requerida para descomponer una red. El diferencia clave Entre la energía de la solvatación y la energía de la red es que La energía de la solvatación da el cambio de entalpía al disolver un soluto en un disolvente, mientras que la energía de la red da el cambio de entalpía cuando la formación (o desglose) de una red.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la energía de solvatación?
3. ¿Qué es la energía de la red?
4. Comparación de lado a lado: energía de solvatación vs energía de red en forma tabular
5. Resumen
¿Qué es la energía de solvatación??
La energía de solvatación es el cambio en la energía de Gibbs cuando un ion o molécula se transfiere de un vacío (o la fase gaseosa) a un solvente. La solvatación es la interacción entre un disolvente y moléculas o iones de un soluto. El soluto es el compuesto que se disolverá en el solvente. Algunos solutos están compuestos de moléculas, mientras que algunos contienen iones.
La interacción entre las partículas de solvente y soluto determina muchas de las propiedades de un soluto. Ej: solubilidad, reactividad, color, etc. Durante el proceso de solvatación, las partículas de soluto están rodeadas de moléculas de solventes que forman complejos de solvatación. Cuando el solvente involucrado en esta solvatación es agua, el proceso se llama hidratación.
Se forman diferentes tipos de enlaces químicos e interacciones durante el proceso de solvatación; enlaces de hidrógeno, interacciones iones-dipolo y fuerzas de van der Waal. Las propiedades complementarias del solvente y el soluto determinan la solubilidad de un soluto en un solvente. Por ejemplo, la polaridad es un factor importante que determina la solubilidad de un soluto en un solvente. Los solutos polares se disuelven bien en solventes polares. Los solutos no polares se disuelven bien en solventes no polares. Pero la solubilidad de los solutos polares en solventes no polares (y viceversa) es pobre.

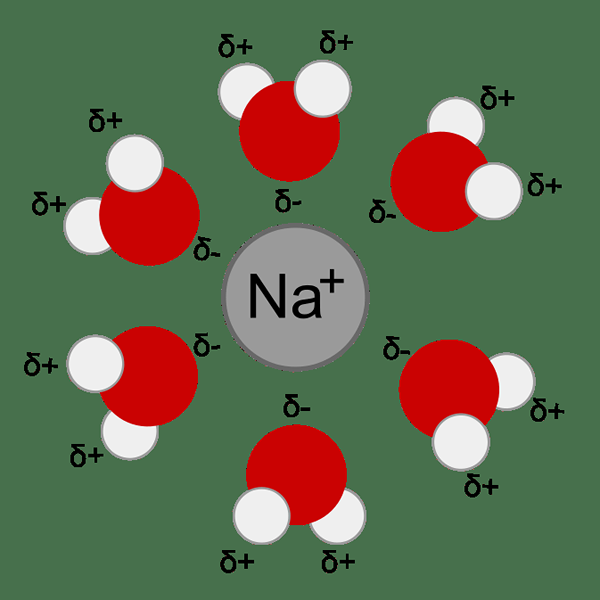
Figura 01: solvatación de un catión de sodio en agua
Cuando se trata de la termodinámica, la solvatación es posible (espontánea) solo si la energía Gibbs de la solución final es menor que las energías individuales de Gibbs de solvente y soluto. Por lo tanto, la energía libre de Gibbs debe ser un valor negativo (la energía libre de Gibbs del sistema debe disminuir después de la formación de la solución). La solvatación incluye diferentes pasos con diferentes energías.
- Formación de una cavidad de solvente para hacer espacio para solutos. Esto es termodinámicamente desfavorable porque cuando las interacciones entre la molécula solvente disminuyen y la entropía disminuye.
- La separación de la partícula de soluto del volumen también es termodinámicamente desfavorable. Esto se debe a que las interacciones soluto-soluto disminuyen.
- Las interacciones con disolvente se producen cuando el soluto entra en la cavidad del solvente es termodinámicamente favorable.
La energía de la solvatación también se conoce como la entalpía de la solvatación. Es útil explicar la disolución de algunas redes en solventes mientras que algunas redes no. El cambio de la entalpía de la solución es la diferencia entre las energías de liberar un soluto de granel y combinar soluto con solvente. Si un ion tiene un valor negativo para el cambio de solución de entalpía, indica que es más probable que el ion se disuelva en ese solvente. Un alto valor positivo indica que el ion es menos probable que se disuelva.
¿Qué es la energía de la red??
La energía de la red es una medida de la energía contenida en la red de cristal de un compuesto, igual a la energía que se liberaría si los iones componentes se unieran desde el infinito. La energía reticular de un compuesto también se puede definir como la cantidad de energía requerida para descomponer un sólido iónico en sus átomos en la fase gaseosa.
Los sólidos iónicos son compuestos muy estables debido a las entalpías de formación de moléculas iónicas junto con la estabilidad debido a la energía de la red de la estructura sólida. Pero la energía de la red no se puede medir experimentalmente. Por lo tanto, un Ciclo de nacimiento nacido se usa para determinar la energía de la red de los sólidos iónicos. Hay varios términos que deben entenderse antes de dibujar un ciclo de Haber Born.
- Energía de ionización: la cantidad de energía requerida para eliminar un electrón de un átomo neutro en el gaseoso
- Afinidad electrónica: la cantidad de energía que se libera cuando un electrón se agrega a un átomo neutro en el gaseoso
- Energía de disociación: la cantidad de energía requerida para separar un compuesto en átomos o iones.
- Energía de sublimación: la cantidad de energía requerida para convertir un sólido en su vapor
- El calor de la formación: el cambio de energía cuando se forma un compuesto a partir de sus elementos.
- Ley de Hess: una ley que establece que el cambio general en la energía de un determinado proceso puede determinarse dividiendo el proceso en diferentes pasos.
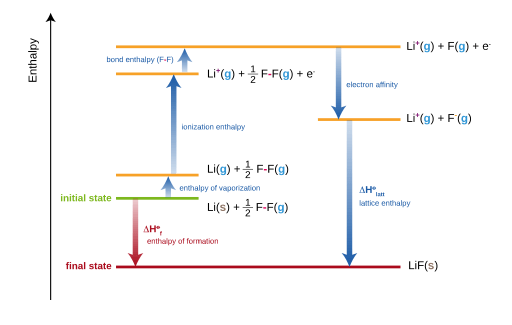
Figura 02: El ciclo de Habor nacido para la formación de fluoruro de litio (LIF)
El ciclo de Haber Born puede ser dado por la siguiente ecuación.
Calor de formación = calor de atomización + energía de disociación + suma de energías de ionización + suma de afinidades de electrones + energía en red
Luego, la energía de la red de un compuesto se puede obtener reorganizando esta ecuación de la siguiente manera.
Energía de red = calor de formación - calor de atomización + energía de disociación + suma de energías de ionización + suma de afinidades de electrones
¿Cuál es la diferencia entre la energía de solvatación y la energía de la red??
Energía de solvatación vs energía de red | |
| La energía de solvatación es el cambio en la energía de Gibbs cuando un ion o molécula se transfiere de un vacío (o la fase gaseosa) a un solvente. | La energía de la red es una medida de la energía contenida en la red de cristal de un compuesto, igual a la energía que se liberaría si los iones componentes se unieran desde el infinito. |
| Principio | |
| La energía de la solvatación da el cambio de entalpía al disolver un soluto en un solvente. | La energía de la red da el cambio de entalpía cuando la formación (o desglose) de una red. |
Resumen - Energía de solvatación VS Energía reticular
La energía de la solvatación es el cambio de entalpía de un sistema durante la solvatación de un soluto en un solvente. La energía de la red es la cantidad de energía liberada durante la formación de una red o la cantidad de energía requerida para descomponer una red. La diferencia entre la energía de la solvatación y la energía de la red es que la energía de solvatación da el cambio de entalpía al disolver un soluto en un solvente, mientras que la energía de la red da el cambio de entalpía cuando la formación (o descomposición) de una liga.
Referencia:
1."Energía reticular."Chem.puñetazo.edu. Disponible aquí
2.Unión internacional de Química Pura Aplicada. "Energía de solvatación."Iupac Gold Book - Energía de solvatación. Disponible aquí
3."Solucación."Wikipedia, Fundación Wikimedia, 5 Mar. 2018. Disponible aquí
Imagen de cortesía:
1.'Na+H2O'By Taxman (dominio público) a través de Commons Wikimedia
2.'Born-Haber Cycle Lif'by Jkwchui-Trabajo propio, (CC By-Sa 3.0) a través de Commons Wikimedia


