Diferencia entre solvente y soluto

El diferencia clave entre el solvente y el soluto es que el El soluto es el que se disolverá mientras, el solvente es responsable de disolverlo.
Una solución es una mezcla homogénea de dos o más sustancias. Lo nombramos una mezcla homogénea porque la composición es uniforme en toda la solución. Además, los componentes de una solución son principalmente de dos tipos, solutos y los solventes. El solvente disuelve los solutos y forma una solución uniforme. Entonces, normalmente la cantidad de solvente es mayor que la cantidad de soluto.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es solvente
3. Que es soluto
4. Comparación de lado a lado - solvente vs soluto en forma tabular
5. Resumen
Que es solvente?
El solvente es una sustancia con capacidad de disolución. Por lo tanto, puede disolver otra sustancia. Además, los solventes pueden ocurrir en estado líquido, gaseoso o sólido. Sin embargo, más comúnmente, usamos líquidos como solventes. Además, entre los líquidos, el agua es común como solvente universal, porque puede disolver muchas sustancias que cualquier otro solvente. Además, podemos disolver gas, sólido o cualquier otro soluto líquido en solventes líquidos. Pero, en solventes de gas, solo los solutos de gas se disolverán.

Figura 01: el ácido acético es útil como solvente orgánico
Además, hay un límite para la cantidad de solutos que podemos agregar a una cierta cantidad de solvente. Decimos que la solución se ha saturado si hemos agregado la cantidad máxima de solutos al solvente. Hay solventes en dos tipos como solventes orgánicos o inorgánicos. Por ejemplo, el cloruro de éter, hexano y metileno son solventes orgánicos, mientras que el agua es un disolvente inorgánico.
Solventes polares y no polares
Hay dos categorías amplias de solventes como solventes polares y solventes no polares.
Solvente polar Las moléculas tienen una separación de carga, por lo tanto, capaz de disolver los solutos polares. En el proceso de disolución, pueden ocurrir interacciones dipolo-dipolo o interacciones dipolar inducidas por dipolo. Podemos dividir aún más los solventes polares como solventes apropicos polares y apróticos polares. Los solventes de protección polar son capaces de formación de enlaces de hidrógeno con los solutos. Por lo tanto, solvatan aniones por enlaces de hidrógeno. El agua y el metanol son solventes de protección polares. Los solventes apróticos polar no pueden formar enlaces de hidrógeno. Sin embargo, tienen grandes momentos dipolares, por lo tanto, forman interacciones dipolo-dipolo con solutos iónicos, por lo tanto, solváculos. La acetona es un solvente aprótico polar.
Solventes no polares disolver solutos no polares. El hexano, el benceno y el tolueno son algunos solventes no polares comunes.
Además de los solventes clasificados anteriormente, hay algunos solventes, que tienen propiedades polares y no polares intermedias. Según el fenómeno de "disolver como disolver", los solventes disuelven solutos, que los coinciden.
Propiedades
Las propiedades de los solventes son esenciales para saber cuándo los usamos en laboratorios. Por ejemplo, conocer los puntos de ebullición de los solventes nos ayuda a determinar cómo usar métodos de destilación para separarlos. Alternativamente, la densidad de los solventes es importante en las técnicas de extracción de solventes. La volatilidad, la toxicidad y la inflamabilidad son algunos de los otros parámetros, que tenemos que enfocar cuando estamos trabajando con diferentes solventes.
Que es soluto?
El soluto es una sustancia que se disuelve en un solvente para formar una solución. Los solutos pueden ocurrir en fase líquida, gaseosa o sólida. Normalmente, en una solución, los solutos están en menor cantidad que los solventes.

Figura 02: El agua salina contiene sal como soluto
Cuando una solución tiene la cantidad máxima de solutos que puede disolver, entonces decimos que la solución se saturó. La disolución del soluto en el solvente cambia las propiedades de los solventes.
¿Cuál es la diferencia entre solvente y soluto??
El disolvente es una sustancia con capacidad de disolución, por lo que puede disolver otra sustancia, mientras que el soluto es una sustancia que se disuelve en un solvente para formar una solución. Esta es la diferencia clave entre solvente y soluto. Además, hay otras diferencias entre el solvente y el soluto en sus estados físicos, la solubilidad y los puntos de ebullición. Por ejemplo, teniendo en cuenta el punto de ebullición, el punto de ebullición de un soluto suele ser más alto que el de un solvente.
La siguiente infografía muestra más detalles sobre la diferencia entre solvente y soluto.
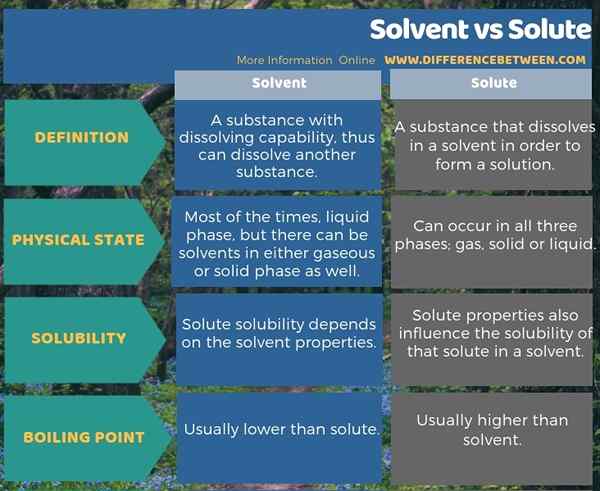
Resumen -solvente vs soluto
Los solutos son sustancias que se disuelven en un solvente para formar una solución. Por lo tanto, la diferencia entre solvente y soluto es que el soluto es el que se disuelve, y el solvente es responsable de disolverlo.
Referencia:
1. "Solvente."Wikipedia, Fundación Wikimedia, 6 de septiembre. 2018. Disponible aquí
2. "Solución."Wikipedia, Fundación Wikimedia, 21 de septiembre. 2018. Disponible aquí
Imagen de cortesía:
1."Ácido acético" por w. Oelen (CC BY-SA 3.0) a través de Commons Wikimedia
2."Saltinwatersolutionliquid" de Chris 73 (CC By-SA 3.0) a través de Commons Wikimedia


