Diferencia entre SP SP2 y SP3
El diferencia clave entre SP SP2 y SP3 es que el Los orbitales híbridos SP tienen características orbitales del 50% S y los orbitales híbridos SP2 tienen características orbitales del 33% S, mientras que los orbitales híbridos SP3 tienen características orbitales del 25% S.
Los términos SP, SP2 y SP3, se refieren a diferentes hibridizaciones de orbitales que conducen a formar orbitales híbridos. Los orbitales son regiones hipotéticas alrededor de un núcleo de un átomo, que contienen electrones de ese átomo. Estos orbitales pueden sufrir hibridación para formar nuevos orbitales híbridos que puedan formar enlaces químicos covalentes. Hay varias formas de hibridizaciones según los orbitales atómicos que participan en el proceso de hibridación. SP, SP2 y SP3 son algunas hibridizaciones comunes que involucran en los orbitales S y P de un átomo.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es sp
3. Que es sp2
4. Que es sp3
5. Comparación lado a lado - SP vs SP2 vs SP3 en forma tabular
6. Resumen
Que es sp?
La hibridación SP es la forma más simple de hibridación en la que un orbital S se superpone con un orbital P para formar dos nuevos orbitales SP. Una carcasa de electrones contiene tres orbitales P. En esta hibridación, uno de estos tres orbitales P se mezcla con un orbital S del mismo átomo. Por lo tanto, quedan dos orbitales de P no hibridados en estos átomos.

Figura 01: Disposición espacial de los orbitales híbridos SP
La relación de mezcla de los dos orbitales atómicos es 1: 1 (s: p). Por lo tanto, el nuevo orbital híbrido tiene el 50% de las características orbitales S y el 50% de las características orbitales de P. Esta mezcla de los orbitales atómicos S y P forma dos nuevos orbitales híbridos. Estos dos orbitales se arreglan en una disposición espacial lineal; Dirigir cada orbital atómico a las direcciones opuestas. Esta disposición da como resultado la menor tensión entre los dos orbitales. Por lo tanto, el ángulo de enlace será de 180 °.
Que es sp2?
La hibridación SP2 es una forma de hibridación orbital en la que una S orbital se superpone con dos orbitales P para formar tres nuevos orbitales híbridos. Dado que hay tres orbitales atómicos de P en un átomo, esta hibridación deja un orbital P no hibrado. A diferencia de la hibridación SP, en esta forma de hibridación, la característica S de cada orbital híbrido SP2 está presente 33%, mientras que la característica orbital P es del 66%.
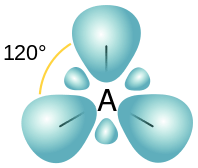
Figura 02: Disposición espacial de los orbitales SP2
Sin embargo, estos son solo valores aproximados porque la relación entre los tres orbitales atómicos implica en esta hibridación es S: P = 1: 2.
Entonces la característica S es igual a 100/3 = 33.33%
Y la característica P es igual (100/3) x 2 = 66.66%
Estos tres nuevos orbitales híbridos obtienen la disposición espacial plana trigonal para minimizar la tensión entre los orbitales. Además, el ángulo de enlace entre estos orbitales es de 120 °.
Que es sp3?
La hibridación SP3 es una forma de hibridación orbital en la que una S orbital se superpone con tres orbitales P. Por lo tanto, no hay orbitales P no hibridados ya que todos los orbitales de P involucran en el proceso de hibridación.

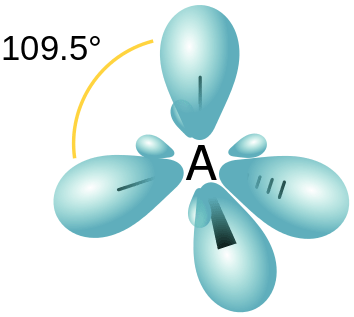
Figura 03: Disposición espacial de los orbitales híbridos SP3
Por lo tanto, esto da como resultado 4 nuevos orbitales híbridos. Dado que la relación entre los orbitales S y P es 1: 3, la característica S de cada orbital híbrido es del 25%, mientras que la característica orbital P es del 75%. Estos nuevos orbitales híbridos hacen arreglos en una disposición tetraédrica con 109.Ángulo de enlace de 5 °.
¿Cuál es la diferencia entre SP SP2 y SP3??
La hibridación SP es la forma más simple de hibridación en la que un orbital S se superpone con un P orbital para formar dos nuevos orbitales SP, y una hibridación SP2 es una forma de hibridación orbital en la que una S orbital se superpone con dos orbitales P para formar tres nuevos orbitales híbridos nuevos Mientras que la hibridación SP3 es una forma de hibridación orbital en la que una se superpone a un orbital con tres orbitales P. Esta es la diferencia fundamental entre los orbitales híbridos SP SP2 y SP3. Además, cada uno de los nuevos orbitales híbridos que se forman en estas tres formas de hibridaciones tiene diferentes características orbitales de S porque los orbitales S se mezclan con diferentes números de orbitales P. Por lo tanto, también tienen diferentes características orbitales.
Sin embargo, podemos enfatizar la principal diferencia entre la hibridación SP2 y SP3 de acuerdo con la característica s de estos orbitales híbridos; Los orbitales híbridos SP tienen características orbitarias del 50% S, y los orbitales híbridos SP2 tienen características orbitales del 33% S, mientras que los orbitales híbridos SP3 tienen características orbitales del 25% S. Además, cada hibridación deja diferentes números de orbitales no hibridados. Por ejemplo, la hibridación SP implica solo 1 P orbitales atómicos. Por lo tanto, deja dos orbitales atómicos de P sin hibridados.
La siguiente infografía muestra una comparación detallada de lado a lado sobre la diferencia entre la hibridación SP SP2 y SP3.

Resumen -SP SP2 vs SP3
La hibridación es un proceso en el que los orbitales atómicos se mezclan entre sí para formar nuevos orbitales híbridos que pueden sufrir unión química covalente. Las formas más simples de hibridaciones orbitales atómicas son las hibridaciones SP, SP2 y SP3. La diferencia clave entre SP2 y SP3 es que los orbitales híbridos SP tienen características orbitales del 50% S y los orbitales híbridos SP2 tienen características orbitales del 33% S, mientras que los orbitales híbridos SP3 tienen un 25% de características orbitales S.
Referencia:
1. "Hibridización orbital."Wikipedia, Fundación Wikimedia, 13 de septiembre. 2018. Disponible aquí
2. Bibliotecas. "Hibridación."Bibliotecas de química, Librettexts, 21 de julio de 2016. Disponible aquí
Imagen de cortesía:
1."Ae2h" de Jfmelero - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia
2."AE3H" por JFMelero - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia
3."Ae4h" de Jfmelero - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia


