Diferencia entre la hibridación SP3D2 y D2SP3
Diferencia de clave: SP3D2 vs D2SP3 Hibridación
Hay estructuras hipotéticas conocidas como orbitales en un átomo en el que residen los electrones. Diferentes descubrimientos científicos han propuesto diferentes formas para estos orbitales. Los orbitales atómicos pueden sufrir un proceso conocido como hibridación. Se produce la hibridación de los orbitales para obtener formas adecuadas necesarias para la unión química. La hibridación es la mezcla de orbitales atómicos para formar orbitales híbridos. sp3d2 y D2sp3 son tales orbitales híbridos. El diferencia clave entre SP3d2 y D2sp3La hibridación es que sp3d2 La hibridación implica orbitales atómicos de la misma carcasa de electrones, mientras que D2sp3 La hibridación implica orbitales atómicos de dos capas de electrones.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la hibridación SP3D2?
3. ¿Qué es la hibridación D2SP3?
4. Similitudes entre la hibridación SP3D2 y D2SP3
5. Comparación lado a lado: hibridación SP3D2 vs D2SP3 en forma tabular
6. Resumen
¿Qué es la hibridación SP3D2?
sp3d2 La hibridación es la mezcla de orbitales atómicos S, P y D de la misma carcasa de electrones para formar SP3d2 orbitales híbridos. Allí, uno s orbital atómico, tres orbitales atómicos P y dos orbitales atómicos d se mezclan entre sí. Esta mezcla da como resultado seis orbitales híbridos del mismo tamaño y forma, pero diferentes de su orientación.
El SP3d2 Los orbitales híbridos se organizan en la disposición octaédrica. Estos orbitales híbridos tienen 90O ángulos entre dos orbitales en la disposición octaédrica. La disposición octaédrica muestra un plano cuadrado que tiene cuatro orbitales híbridos y los dos orbitales restantes están orientados por encima y por debajo de este plano cuadrado (perpendicular a este plano).
Ejemplo
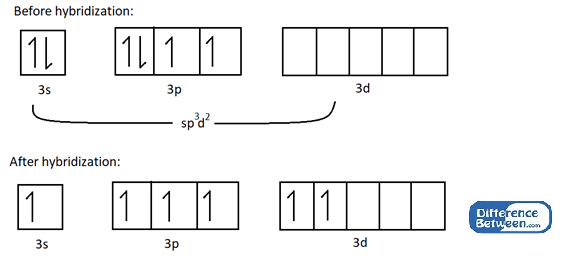
Consideremos un ejemplo para comprender el SP3d2 hibridación. Ej: La molécula SF6 tiene una forma octaédrica porque los orbitales atómicos 3S, 3P y 3D de los átomos de azufre se mezclan a Formsp3d2 orbitales híbridos.

Figura 01: Estructura electrónica del átomo de azufre antes y después de la hibridación.
Como se muestra en la imagen anterior, la hibridación da como resultado seis electrones no apareados que pueden participar en la unión química con seis átomos de fluorina. Lo más importante es que todos los orbitales atómicos involucrados en esta hibridación están en la misma carcasa de electrones (en el ejemplo anterior, es n = 3 concha de electrones).
¿Qué es la hibridación D2SP3??
d2sp3 La hibridación es la mezcla de orbitales atómicos S y P de la misma cubierta de electrones con orbitales D de otra carcasa de electrones para formar D2sp3 orbitales híbridos. Esta hibridación da como resultado seis orbitales híbridos. Estos orbitales híbridos están dispuestos en una geometría octaédrica.
Lo más importante, en esta hibridación, los orbitales atómicos d provienen de una cubierta de electrones diferente (carcasa de electrones N-1), mientras que los orbitales atómicos de S y P son de la misma capa de electrones. Consideremos un ejemplo para comprender esta hibridación. La mayoría de los complejos de iones metálicos están compuestos de D2sp3 orbitales hibridados.
Ejemplo
Por ejemplo, toma Co (NH3)3+ complejo.
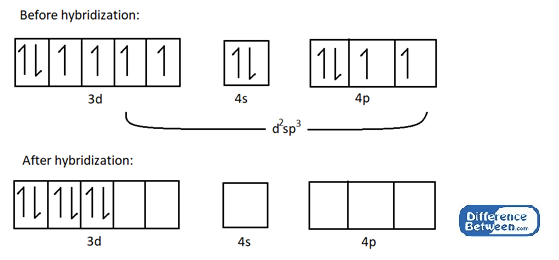
Figura 02: Estructura electrónica del átomo de cobalto (CO) antes y después de la hibridación.
Como se muestra en la imagen de arriba, hay seis orbitales híbridos vacíos en el átomo de cobalto después de la hibridación. Estos orbitales vacíos pueden participar en la formación de enlaces químicos de coordinación con ligandos (aquí ligandos de amoníaco = NH3).
¿Cuáles son las similitudes entre la hibridación SP3D2 y D2SP3??
- Las hibridaciones SP3D2 y D2SP3 dan como resultado la geometría octaédrica.
- Tanto las geometrías de hibridación SP3D2 y D2SP3 tienen 90O ángulo entre los orbitales híbridos.
- Tanto la hibridación SP3D2 como D2SP3 dan como resultado seis orbitales híbridos.
¿Cuál es la diferencia entre la hibridación SP3D2 y D2SP3??
Sp3d2 vs d2sp3 hibridación | |
| sp3d2 La hibridación es la mezcla de orbitales atómicos S, P y D de la misma carcasa de electrones para formar SP3d2 orbitales híbridos. | d2sp3 La hibridación es la mezcla de orbitales atómicos S y P de la misma cubierta de electrones con orbitales D de otra carcasa de electrones para formar D2sp3 orbitales híbridos. |
| Nomenclatura | |
| sp3d2 Formas de hibridación SP3d2orbitales híbridos. | d2sp3 Hibridación D2sp3 orbitales híbridos. |
| Tipo de orbitales atómicos | |
| sp3d2 La hibridación implica orbitales atómicos de la misma carcasa de electrones. | d2sp3 La hibridación implica orbitales atómicos de dos capas de electrones. |
| D Orbitales | |
| sp3d2 La hibridación implica d orbitales atómicos de la carcasa de electrones N. | d2sp3 La hibridación implica d orbitales atómicos de la carcasa de electrones N-1. |
Resumen - sp3d2 vs D2SP3 Hibridación
sp3d2 hibridación y D2sp3 La hibridación son términos confusos que la mayoría de las veces se usan indistintamente por error. Estos son diferentes en muchos sentidos. La diferencia clave entre SP3d2 y D2sp3La hibridación es que, sp3d2 La hibridación implica orbitales atómicos de la misma carcasa de electrones, mientras que D2sp3 La hibridación implica orbitales atómicos de dos capas de electrones.
Descargue la versión PDF de SP3D2 vs D2SP3 Hybridization
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según la nota de cita. Descargue la versión PDF aquí: Diferencia entre la hibridación SP3D2 y D2SP3
Referencia:
1."8.2: Orbitales atómicos híbridos."Bibliotecas de química, Librettexts, 30 de agosto. 2017. Disponible aquí