Diferencia entre reacciones espontáneas y no depontáneas
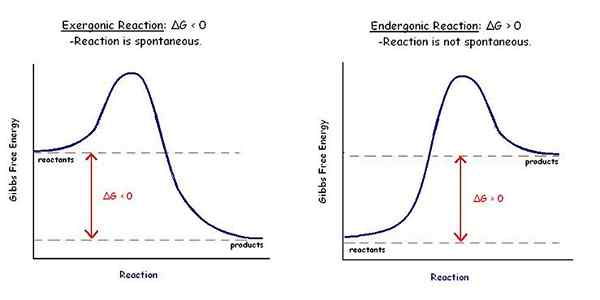
El diferencia clave Entre reacciones espontáneas y no depontáneas es que la Las reacciones espontáneas tienen una energía libre de Gibbs negativa, mientras que las reacciones no espontáneas tienen una energía libre de Gibbs positiva.
Las reacciones pueden ser reacciones químicas o reacciones biológicas. Podemos dividir estas reacciones en dos categorías como reacciones espontáneas y reacciones no espontáneas. Una reacción espontánea ocurre sin ninguna influencia externa. Pero las reacciones no espontáneas no pueden progresar sin una influencia externa. Discutamos más detalles sobre estas reacciones y tabule la diferencia entre las reacciones espontáneas y no propias.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las reacciones espontáneas?
3. ¿Cuáles son las reacciones no favorables?
4. Comparación de lado a lado: reacciones espontáneas vs no posontáneas en forma tabular
5. Resumen
¿Qué son las reacciones espontáneas??
Las reacciones espontáneas son reacciones químicas o biológicas que tienen lugar sin la influencia de ningún factor externo. Además, estas reacciones favorecen el aumento de la entropía al tiempo que disminuye la entalpía de un sistema termodinámico. Dado que estas reacciones no necesitan factor externo, ocurren naturalmente. Por lo tanto, estas reacciones favorecen la formación de los productos bajo las condiciones en las que ocurre la reacción. La energía libre de Gibbs de una reacción espontánea es un valor negativo.
La mayoría de las reacciones espontáneas ocurren rápidamente porque favorece la formación de productos en lugar de mantener el reactivo como es. Ej: combustión de hidrógeno. Pero algunas reacciones ocurren extremadamente lentamente. Ej: conversión de grafito en diamantes. Además, en algunas reacciones reversibles, se favorece una dirección de reacción en la otra dirección. Por ejemplo, en la formación de dióxido de carbono y agua del ácido carbónico, se favorece la reacción hacia adelante; La formación de dióxido de carbono y agua es espontánea.
H2CO3 ↔ CO2 + H2O
¿Cuáles son las reacciones no favorables??
Las reacciones no espontáneas son reacciones químicas o biológicas que no pueden tener lugar sin la influencia de ningún factor externo. Por lo tanto, estas reacciones no sufren en las condiciones naturales.

Figura 01: Comparación de reacciones espontáneas y no espontáneas
Por lo tanto, tenemos que proporcionar algún factor externo para que estas reacciones progresen. Ej: Podemos proporcionar calor, dar algo de presión, agregar un catalizador, etc. Además, la energía libre de Gibbs es positiva para estas reacciones.
Casi todas las reacciones no positivas son endotérmicas; liberan energía al exterior. Estas reacciones acompañan una disminución en la entropía. Ej: La formación de monóxido de nitrógeno (sin gas) a partir de la reacción entre el oxígeno y el nitrógeno en nuestra atmósfera es no depontánea a condiciones normales de temperatura y presión. Sin embargo, esta reacción ocurre a temperaturas muy altas.
¿Cuál es la diferencia entre las reacciones espontáneas y no??
Las reacciones espontáneas son reacciones químicas o biológicas que tienen lugar sin la influencia de ningún factor externo. Favorecen el aumento de la entropía mientras disminuyen la entalpía de un sistema termodinámico. Además, la energía libre de Gibbs de una reacción espontánea es un valor negativo. Mientras que las reacciones no espontáneas son reacciones químicas o biológicas que no pueden tener lugar sin la influencia de ningún factor externo. No favorecen el aumento de la entropía o la disminución de la entalpía en condiciones normales. Además, la energía libre de Gibbs de una reacción no espontánea es un valor positivo.

Resumen -Reacciones espontáneas vs no posontáneas
Todas las reacciones pertenecen a dos tipos de reacciones, como reacciones espontáneas y reacciones no espontáneas. La diferencia entre las reacciones espontáneas y no posontáneas es que las reacciones espontáneas tienen una energía libre de Gibbs negativa, mientras que las reacciones no espontáneas tienen una energía libre de Gibbs positiva.
Referencia:
1. Bibliotecas. "11.5: Reacciones espontáneas y energía libre."Bibliotecas de química, Librettexts, 13 de julio de 2018. Disponible aquí
2. Ciencia, CK12. "Reacciones espontáneas y no posontáneas."Fundación CK-12, Fundación CK-12, 28 Mar. 2017. Disponible aquí
Imagen de cortesía:
1.'Gibbs Free Energy' por Stephjc - Trabajo propio, (dominio público) a través de Commons Wikimedia


