Diferencia entre la función de estado y la función de ruta
Diferencia de clave: función de estado vs ruta
La termodinámica es una rama importante de la química física que indica las relaciones termoquímicas con diferentes formas de energía y trabajo. Hay cuatro leyes termodinámicas utilizadas para describir el comportamiento de un sistema termodinámico. La función de estado y la función de ruta son dos formas de expresar diferentes propiedades termodinámicas de los sistemas. La diferencia clave entre la función de estado y la función de ruta es que Las funciones de estado no dependen de la ruta o el proceso, mientras que las funciones de ruta dependen de la ruta o el proceso. Por lo tanto, la función de estado y la función de ruta son opuestas entre sí.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la función de estado?
3. ¿Qué es la función de ruta?
4. Similitudes entre la función de estado y la función de ruta
5. Comparación de lado a lado: función de estado frente a la función de ruta en forma tabular
6. Resumen
¿Qué es la función de estado?
La función de estado es un término termodinámico que se usa para nombrar una propiedad cuyo valor no depende de la ruta tomada para alcanzar ese valor específico. Las funciones estatales también se conocen como Funciones de puntos. Una función de estado solo depende del estado actual del sistema termodinámico y su estado inicial (independiente de la ruta). La función de estado de un sistema termodinámico describe el estado de equilibrio de ese sistema, independientemente de cómo llegó el sistema a ese estado.
Ejemplos de funciones estatales
- Masa
- Energía - entalpía, energía interna, Gibbs Free Energy, etc.
- Entropía
- Presión
- Temperatura
- Volumen
- Composición química
- Altitud
Una función de estado depende de tres cosas: la propiedad, el valor inicial y el valor final. La entalpía es una función de estado. Se puede dar como una expresión matemática como se da a continuación.
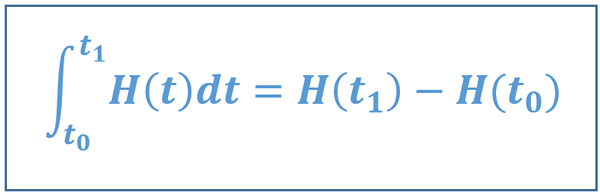
En el que, t1 es el estado final, t0 es el estado inicial y h es la entalpía del sistema.
¿Qué es la función de ruta??
La función de ruta es un término termodinámico que se usa para nombrar una propiedad cuyo valor depende de la ruta tomada para alcanzar ese valor específico. En otras palabras, una función de ruta depende de la ruta tomada para llegar a un estado final desde un estado inicial. La función de ruta también se llama función de proceso.
Una función de ruta proporciona diferentes valores para diferentes rutas. Por lo tanto, las funciones de ruta tienen valores variables dependiendo de la ruta. Por lo tanto, al expresar la función de ruta matemáticamente, se requieren múltiples integrales y límites para integrar la función de ruta.
Ejemplos de funciones de ruta
- Trabajo mecánico
- Calor
- Longitud de arco
La energía interna viene dada por la siguiente ecuación:
∆U = Q + W
En el que ∆U es el cambio en la energía interna, Q es el calor y W es el trabajo mecánico. La energía interna es una función de estado, pero el calor y el trabajo son funciones de ruta.
¿Cuáles son las similitudes entre la función de estado y la función de ruta??
- Ambas son funciones descritas en termodinámica.
- Ambas son propiedades de los sistemas termodinámicos.
¿Cuál es la diferencia entre la función de estado y la función de ruta??
Función de estado vs ruta función | |
| La función de estado es un término termodinámico que se usa para nombrar una propiedad cuyo valor no depende de la ruta tomada para alcanzar ese valor específico. | La función de ruta es un término termodinámico que se usa para nombrar una propiedad cuyo valor depende de la ruta tomada para alcanzar ese valor específico. |
| Otros nombres | |
| Las funciones estatales también se denominan funciones puntuales. | Las funciones de ruta también se denominan funciones de proceso. |
| Proceso | |
| Las funciones estatales no dependen de la ruta o el proceso. | Las funciones de ruta dependen de la ruta o el proceso. |
| Integración | |
| La función de estado se puede integrar utilizando los valores iniciales y finales de la propiedad termodinámica del sistema. | La función de ruta requiere múltiples integrales y límites de integración para integrar la propiedad. |
| Valores | |
| El valor de la función de estado sigue siendo el mismo independientemente del número de pasos. | El valor de la función de ruta de un proceso de un solo paso es diferente de un proceso de múltiples pasos. |
| Ejemplos | |
| Las funciones de estado incluyen entropía, entalpía, masa, volumen, temperatura, etc. | Las funciones de la ruta incluyen calor y trabajo mecánico. |
Resumen -función de estado vs ruta
La función de estado y la función de ruta son dos formas de expresiones termodinámicas que dan diferentes propiedades de los sistemas termodinámicos. Estos términos son diferentes entre sí; La diferencia clave entre la función de estado y la función de ruta es que las funciones de estado no dependen de la ruta o el proceso, mientras que las funciones de ruta dependen de la ruta o el proceso.
Referencia:
1. "Función estatal."Wikipedia, Fundación Wikimedia, 24 de febrero. 2018, disponible aquí.
2. "Estado vs. Funciones de ruta."Bibliotecas de química, Librettexts, 23 de enero. 2018, disponible aquí.


