Diferencia entre ligando fuerte y ligando débil
Diferencia clave: ligando fuerte VS Ligando débil
Un ligando es un átomo, ion o una molécula que dona o comparte dos de sus electrones a través de un enlace covalente coordinado con un átomo o ion central. El concepto de ligandos se discute bajo química de coordinación. Los ligandos son especies químicas que están involucradas en la formación de complejos con iones metálicos. Por lo tanto, también se conocen como agentes complejos. Los ligandos pueden ser monodentados, bidentados, tridentados, etc. Basado en la denticidad del ligando. La denticidad es el número de grupos de donantes presentes en un ligando. Monodentate significa que el ligando tiene solo un grupo de donantes. Bidentate significa que tiene dos grupos de donantes por una molécula de ligando. Hay dos tipos principales de ligandos categorizados según la teoría del campo de cristal; ligandos fuertes (o ligandos de campo fuertes) y ligandos débiles (o ligandos de campo débiles). El diferencia clave entre ligandos fuertes y ligandos débiles es que La división de los orbitales después de unirse a un ligando de campo fuerte provoca una mayor diferencia entre los orbitales de nivel de energía más alto y más bajo, mientras que la división de los orbitales después de unirse a un ligando de campo débil provoca una diferencia más baja entre los orbitales de nivel de energía más alto y más bajo.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la teoría del campo de cristal?
3. ¿Qué es el ligando fuerte?
4. ¿Qué es el ligando débil?
5. Comparación lado a lado: ligando fuerte vs ligando débil en forma tabular
6. Resumen
¿Qué es la teoría del campo de cristal??
La teoría del campo de los cristales se puede describir como un modelo que está diseñado para explicar la ruptura de las degeneraciones (cáscaras de electrones de igual energía) de los orbitales de electrones (generalmente D o F orbitales) debido al campo eléctrico estático producido por un anión o aniones circundantes (o aniones (o (o o aniones (o (o aniones (o ligandos). Esta teoría se usa a menudo para demostrar el comportamiento de los complejos de iones de metales de transición. Esta teoría puede explicar las propiedades magnéticas, los colores de los complejos de coordinación, las entalpías de hidratación, etc.
Teoría:
La interacción entre el ion metálico y los ligandos es el resultado de la atracción entre el ion metálico con una carga positiva y la carga negativa de los electrones no apareados del ligando. Esta teoría se basa principalmente en los cambios que ocurren en cinco orbitales de electrones degenerados (un átomo de metal tiene cinco orbitales d). Cuando un ligando se acerca al ion metal, los electrones no apareados están más cerca de algunos orbitales D que los de otros orbitales D del ion metálico. Esto causa una pérdida de degeneración. Y también, los electrones en los orbitales D repelen los electrones del ligando (porque ambos están negativos cargados). Por lo tanto, los orbitales d que están más cerca del ligando tienen alta energía que la de otros orbitales D. Este resultado en la división de orbitales D en orbitales D de alta energía y orbitales D de baja energía, en función de la energía.
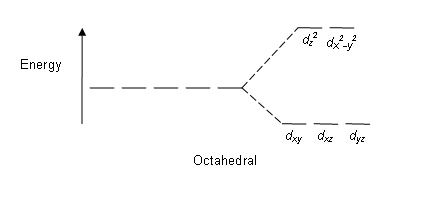
Algunos factores que afectan esta división son; Naturaleza del ion metálico, el estado de oxidación del ion metálico, la disposición de los ligandos alrededor del ion metálico central y la naturaleza de los ligandos. Después de la división de estos orbitales D basados en la energía, la diferencia entre los orbitales D de alta energía y baja energía se conoce como un parámetro de división de campo de cristal (∆oct para complejos octaédricos).

Figura 01: Patrón de división en complejos octaédricos
Patrón de división: Dado que hay cinco orbitales D, la división ocurre en una relación de 2: 3. En los complejos octaédricos, dos orbitales están en el alto nivel de energía (conocido colectivamente como 'p.ej'), y tres orbitales están en el nivel de energía más bajo (conocido colectivamente como T2G). En los complejos tetraédricos, ocurre lo contrario; Tres orbitales están en el nivel de energía más alto y dos en el nivel de energía más bajo.
¿Qué es el ligando fuerte??
Un ligando fuerte o un ligando de campo fuerte es un ligando que puede dar como resultado una mayor división del campo de cristal. Esto significa que la unión de un ligando de campo fuerte causa una mayor diferencia entre los orbitales de nivel de energía más alto y más bajo. Los ejemplos incluyen CN- (ligandos cianuro), no2- (Nitro Ligand) y Co (ligandos carbonílicos).
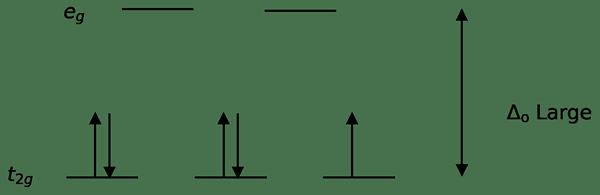
Figura 02: división de giro bajo
En la formación de complejos con estos ligandos, al principio, los orbitales de energía más bajos (T2G) están completamente llenos de electrones antes de llenar a cualquier otro orbital de alto nivel de energía (por ejemplo). Los complejos formados de esta manera se denominan "complejos de giro bajo".
¿Qué es el ligando débil??
Un ligando débil o un ligando de campo débil es un ligando que puede provocar una división de campo de cristal más bajo. Esto significa que la unión de un ligando de campo débil causa una diferencia menor entre los orbitales de nivel de energía más alto y más bajo.
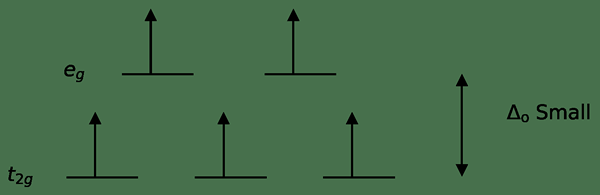
Figura 3: división de giro alto
En este caso, dado que la baja diferencia entre los dos niveles orbitales provoca repulsiones entre electrones en esos niveles de energía, los orbitales de energía más altos pueden llenarse fácilmente con electrones en comparación con las de baja energía orbitales. Los complejos formados con estos ligandos se llaman "complejos de alto giro". Los ejemplos de ligandos de campo débiles incluyen i- (ligando yoduro), br- (ligando de bromuro), etc.
¿Cuál es la diferencia entre ligando fuerte y ligando débil??
Ligando fuerte vs ligando débil | |
| Un ligando fuerte o un ligando de campo fuerte es un ligando que puede dar como resultado una mayor división del campo de cristal. | Un ligando débil o un ligando de campo débil es un ligando que puede provocar una división de campo de cristal más bajo. |
| Teoría | |
| La división después de unir un ligando de campo fuerte provoca una mayor diferencia entre los orbitales de nivel de energía más alto y más bajo. | La división de los orbitales después de unir un ligando de campo débil provoca una diferencia menor entre los orbitales de nivel de energía más alto y más bajo. |
| Categoría | |
| Los complejos formados con ligandos de campo fuertes se denominan "complejos de bajo giro". | Los complejos formados con ligandos de campo débiles se denominan "complejos de alto giro". |
Resumen - Ligando fuerte VS Ligando débil
Los ligandos fuertes y los ligandos débiles son aniones o moléculas que causan la división de los orbitales D de un ion metálico en dos niveles de energía. La diferencia entre los ligandos fuertes y los ligandos débiles es que la división después de unir un ligando de campo fuerte provoca una mayor diferencia entre los orbitales de nivel de energía más alto y más bajo, mientras que la división de los orbitales después de unir un ligando de campo débil provoca una diferencia más baja entre el más alto y más bajo. Orbitales de nivel de energía.
Referencia:
1.Helmenstine, Anne Marie, D. "Definición del ligando."Thinkco, febrero. 11, 2017. Disponible aquí
2."Ligandos."Bibliotecas de química, Librettexts, 19 de enero. 2018. Disponible aquí
3.Los editores de Encyclopædia Britannica. "Ligando."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 12 de agosto. 2010. Disponible aquí
Imagen de cortesía:
1.'División de campo de cristal octaédrico' por el usuario de Wikipedia en inglés Yana, (CC By-SA 3.0) a través de Commons Wikimedia
2.'CFT-LOW SPIN DIAGRAMA DE DIAGRAMACIÓN DEL SPINE' por Offnfopt, (dominio público) a través de Commons Wikimedia
3.'Diagrama de división de spinte de CFT-Vector de división' por Offnfopt, Imagen de referencia creada por Yana-Trabajo propio (dominio público) a través de Commons Wikimedia