Diferencia entre hexafluoruro de azufre y tetrafluoruro de disulfur
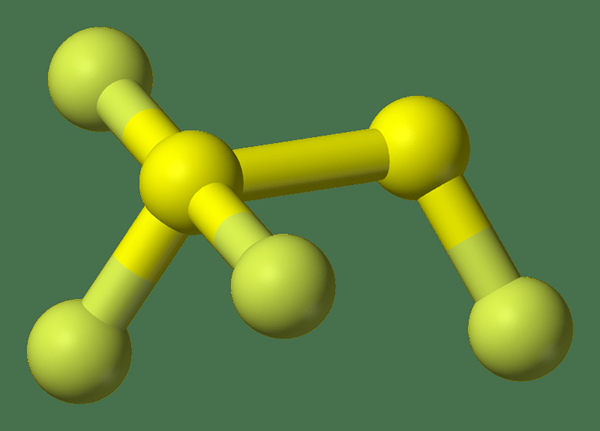
El diferencia clave Entre el hexafluoruro de azufre y el tetrafluoruro de disulfur que el hexafluoruro de azufre tiene enlaces químicos con longitudes de enlace iguales, pero el tetrafluoruro disulfur tiene enlaces químicos con diferentes longitudes de enlace.
El hexafluoruro de azufre y el disulfur tetrafluoruro son compuestos inorgánicos. Ambos contienen átomos de azufre y flúor en diferentes conectividad y disposiciones espaciales. Sin embargo, no solo su estructura química, sino también el estado físico y otras propiedades de estos dos compuestos también son diferentes entre sí. Por ejemplo, el hexafluoruro de azufre es un compuesto gaseoso a temperatura ambiente, pero Disulfur Tetrafluoride es un líquido.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el hexafluoruro de azufre?
3. ¿Qué es Disulfur Tetrafluoride?
4. Comparación de lado a lado: hexafluoruro de azufre vs disulfur tetrafluoruro en forma tabular
5. Resumen
¿Qué es el hexafluoruro de azufre??
El hexafluoruro de azufre es un compuesto inorgánico que tiene la fórmula química SF6. Es un compuesto gaseoso incoloro e inodoro que no es inflamable y no tóxico. Se clasifica como un gas de efecto invernadero. También es un aislador eléctrico importante. Es un gas que es más denso que el aire.
La geometría de este compuesto es octaédrica. Las longitudes de enlace de todos los enlaces S-F en esta molécula son iguales. El hexafluoruro de azufre tiene un átomo central de azufre unido a seis átomos de flúor. Además, esta molécula se considera una molécula hipervalente. Eso significa; Esta molécula tiene un elemento de grupo principal que tiene más de ocho electrones de valencia. En esta molécula, el átomo de azufre tiene doce electrones.
Debido a la conectividad de los átomos y su disposición espacial, la molécula de hexafluoruro de azufre es no polar y es insoluble en agua. Pero, es soluble en solventes orgánicos no polares. Podemos producir este compuesto usando el azufre elemental puro y el flúor. Aquí necesitamos exponer S8 Sólido a la F2 gas.
Hay muchas aplicaciones de hexafluoruro de azufre:
- Utilizado como industria eléctrica de aislamiento eléctrico
- En medicina para proporcionar una tamponada en destacamentos de retina
- Como agente de contraste en las imágenes de ultrasonido,
- Como gas trazador en el modelo de dispersión de aire de la carretera de calibración, etc.
¿Qué es Disulfur Tetrafluoride??
Disulfur Tetrafluoride es un compuesto inorgánico que tiene las fórmulas químicas2F4. Más precisamente, podemos escribir la fórmula estructural para este compuesto como FSSF3 porque tiene tres átomos de fluorino unidos a un átomo de azufre y el otro átomo de azufre contiene el átomo de flúor restante. Las longitudes de enlace de esta molécula son diferentes, que es una propiedad poco común de las moléculas inorgánicas.
La masa molar de este compuesto es de 140 g/mol. Existe en el estado líquido a temperatura ambiente. Además, el tetfluoruro disulfur sufre fácilmente la hidrólisis con agua. También reacciona espontáneamente con oxígeno para formar fluoruro de tionilo. Podemos preparar el tetfluoruro de disulfur en el laboratorio utilizando cloruro de azufre que se pasa sobre el fluoruro de potasio a baja presión y baja temperatura. Sin embargo, esta reacción proporciona varios subproductos, incluidos diferentes cloruros y fluoruros del azufre. Podemos separar el compuesto deseado a través de la destilación de baja temperatura.
¿Cuál es la diferencia entre hexafluoruro de azufre y tetrafluoruro de disulfur?
El hexafluoruro de azufre y el tetrafluoruro de disulfur son compuestos inorgánicos que contienen átomos de azufre y flúor. La diferencia clave entre el hexafluoruro de azufre y el tetrafluoruro de disulfurio es que el hexafluoruro de azufre tiene enlaces químicos con igual longitud de enlace, pero el tetrafluoruro de disulfur tiene enlaces químicos con diferentes longitudes de enlace. Además, el hexafluoruro de azufre es un compuesto gaseoso a temperatura ambiente, pero el tetfluoruro de disulfur es un líquido. Entonces, esta es otra diferencia significativa entre el hexafluoruro de azufre y el tetfluoruro de disulfur.
Además, la masa molar del hexafluoruro de azufre es de 146 g/mol, mientras que la masa molar de tetrafluoruro de disulfur es 140 g/mol. Además, podemos producir hexafluoruro de azufre mediante el uso del azufre elemental puro y el fluorino, mientras que la preparación de tetrafluoruro disulfur.

Resumen -Sulfur Hexafluoride vs Disulfur Tetrafluoride
El hexafluoruro de azufre y el tetrafluoruro de disulfur son compuestos inorgánicos que contienen átomos de azufre y flúor. La diferencia clave entre el hexafluoruro de azufre y el tetrafluoruro de disulfuros es que el hexafluoruro de azufre tiene enlaces químicos con longitudes de enlace iguales, mientras que el tetfluoruro de disulfos tiene enlaces químicos con diferentes longitudes de enlace.
Referencia:
1. "Difluorodisulfanedifluoride." Wikipedia, Fundación Wikimedia, 26 de octubre. 2019, disponible aquí.
Imagen de cortesía:
1. "Sulfur-Hexafluoride-3D-VDW" (dominio público) a través de Commons Wikimedia
2. "Disulfur-tetrafluoride-3D-balls" por Benjah-BMM27-Trabajo propio (dominio público) a través de Commons Wikimedia


