Diferencia entre el ácido sulfúrico y el ácido sulfuroso
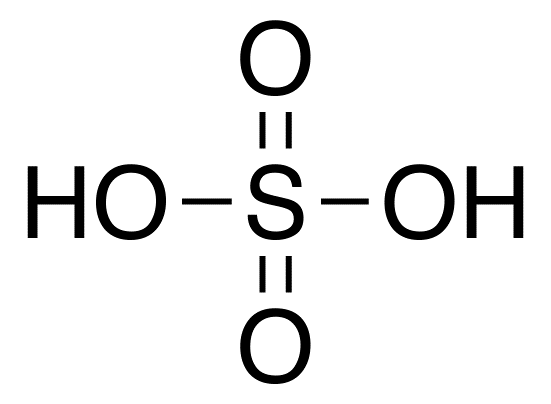
Diferencia clave - Sulfúrico Ácido VS. Ácido sulfúrico
Ácido sulfúrico (h2ENTONCES4) y ácido sulfuroso (H2ENTONCES3) son dos ácidos inorgánicos que contienen azufre, hidrógeno y oxígeno como elementos. El diferencia clave entre ácido sulfúrico y ácido sulfuroso está en el número de oxidación de azufre. Además, cuando comparamos dos ácidos en términos de acidez, El ácido sulfúrico es más ácido que el ácido sulfuroso. En otras palabras, el ácido sulfúrico es un ácido muy fuerte, y el ácido sulfuroso es relativamente débil.
¿Qué es el ácido sulfúrico??
El ácido sulfúrico es un ácido mineral diprótico muy fuerte que es completamente miscible con el agua en cualquier proporción. Disolver ácido sulfúrico en agua es una reacción exotérmica. Es un líquido corrosivo y dañino y causa tantas lesiones, como quemaduras ácidas en la piel o los ojos. Esto incluye efectos a corto y largo plazo dependiendo de la concentración del ácido y el tiempo de contacto. El ácido sulfúrico es altamente corrosivo debido a varios factores; Acidez, capacidad oxidante, deshidratación causada por soluciones concentradas y el calor liberado por la reacción exotérmica.

¿Qué es el ácido sulfuroso??
El ácido sulfuroso tiene la fórmula química de H2ENTONCES3, donde el número de oxidación de azufre es igual a +4. Es un ácido claro, incoloro, débil e inestable. Tiene un olor a azufre en quema. Se forma cuando el dióxido de azufre se disuelve en agua y la forma anhidra pura de ácido sulfuroso nunca se ha aislado o detectado. El ácido sulfuroso se descompone y se disocia en sus componentes químicos rápidamente; ya que es termodinámicamente inestable. La reacción de descomposición es,
H2ENTONCES3 (aq) → H2O(L) + ENTONCES2 (g)
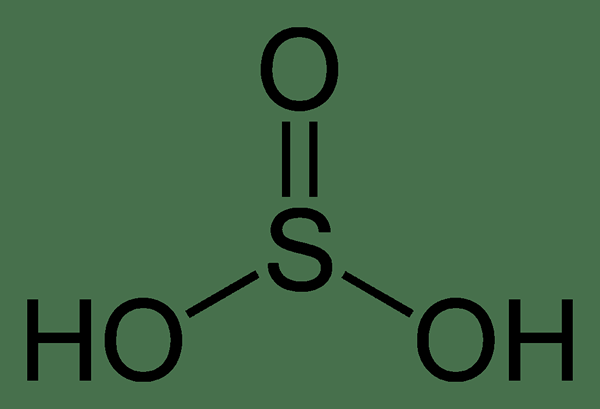
¿Cuál es la diferencia entre el ácido sulfúrico y el ácido sulfuroso??
Estructura y fórmula química:
Ácido sulfúrico: La fórmula química del ácido sulfúrico es H2ENTONCES4 donde el número de oxidación de azufre es +6. La estructura geométrica de esta molécula es tetraédrica.
Ácido sulfúrico: La fórmula química del ácido sulfúrico es H2ENTONCES3 donde el número de oxidación de azufre es +4. La estructura geométrica de esta molécula es trigonal piramidal.
Acidez:
Ácido sulfúrico: El sulfúrico es uno de los ácidos más fuertes, y es un ácido diprótico. Las constantes de disociación de ácido del ácido sulfúrico son; K1 = 2.4 × 106(ácido fuerte) y k2 = 1.0 × 10−2.
Ácido sulfúrico: La acidez del ácido sulfuroso en la escala de pH en igual a 1.5. No se considera un ácido muy fuerte, pero no es un ácido demasiado débil también.
Propiedades:
Ácido sulfúrico: El ácido sulfúrico tiene una característica oxidante y reductora además de sus propiedades ácidas. Por lo tanto, reacciona con metales y no metales; Reacciona como otros ácidos con metales que producen gas de hidrógeno y la sal relevante del metal.
Reacciones con metales:
Fe (s) + H2ENTONCES4 (aq) → h2 (g) + feso4 (aq)
Cu + 2 H2ENTONCES4 → SO2 + 2 H2O +42− + Cu2+
Reacciones con no metales:
C + 2 H2ENTONCES4 → CO2 + 22 + 2 H2O
S + 2 H2ENTONCES4 → 32 + 2 H2O
Ácido sulfúrico: El ácido sulfuroso no existe como una solución en ácido sulfúrico anhidro como una forma anhidra. Sin embargo, hay evidencia de que existen moléculas sulfurosas en fase gaseosa. A diferencia de H2ENTONCES4, El ácido sulfuroso muestra un número muy limitado de reacciones químicas.
Caco3(s) + H2ENTONCES3(aq) → Co2(gramo) + H2O (l) + CASO3(aq)
Usos:
Ácido sulfúrico: El ácido sulfúrico se usa ampliamente en todo el mundo en una amplia gama de industrias. Por ejemplo, se utiliza para producir fertilizantes, explosivos, documentos, detergentes, colorantes y materiales para colorear. Además, es muy importante en la síntesis química, los tratamientos superficiales, la industria del petróleo y los textiles.
Ácido sulfúrico: El ácido sulfuroso se usa como un agente reductor muy fuerte. Tiene algunas propiedades de blanqueo y se usa como agente de blanqueo.
Imagen de cortesía:
1. Estructura química de ácido sulfúrico por DMACKS (trabajo propio) [dominio público], a través de Wikimedia Commons
2. Sulfuroso-ACID-2D por Benjah-BMM27 (trabajo propio) [dominio público], a través de Wikimedia Commons


