Diferencia entre los vacíos tetraédricos y octaédricos
Diferencia clave: tetraédricos vs vacíos octaédricos
Al considerar sustancias inorgánicas muy llenas, hay espacios vacíos que se conocen como vacíos. Los vacíos son espacios desocupados y vacíos de células unitarias en sustancias inorgánicas. Una celda unitaria es una unidad fundamental que muestra la disposición química de toda la sustancia que se compone de unidades de repetición. Los átomos, moléculas o iones de los que se compone el sistema de cristal se conoce generalmente como esferas. En sustancias sólidas muy llenas, hay dos tipos de vacíos que se pueden observar; vacíos tetraédricos y vacíos octaédricos. El diferencia clave entre el vacío tetraédrico y octaédrico es que Los huecos tetraédricos son visibles en sustancias que tienen sistemas de cristal tetraédrico, mientras que los vacíos octaédricos son visibles en sustancias que tienen sistemas de cristal octaédricos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los vacíos tetraédricos?
3. ¿Qué son los vacíos octaédricos?
4. Similitudes entre los vacíos tetraédricos y octaédricos
5. Comparación de lado a lado: vacíos tetraédricos vs octaédricos en forma tabular
6. Resumen
¿Qué son los vacíos tetraédricos??
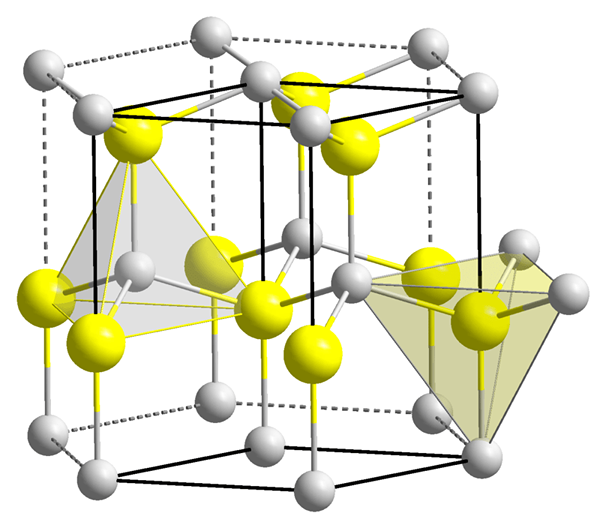
Los vacíos tetraédricos están desocupados, espacios vacíos presentes en sustancias que tienen sistemas de cristal tetraédrico. Por lo tanto, este vacío ocurre entre cuatro componentes. Se forma un vacío tetraédrico cuando un átomo (o esfera) se coloca bajo depresión formado por otros tres átomos (o esferas). Por lo tanto, dos capas atómicas están involucradas en la formación de un vacío tetraédrico.
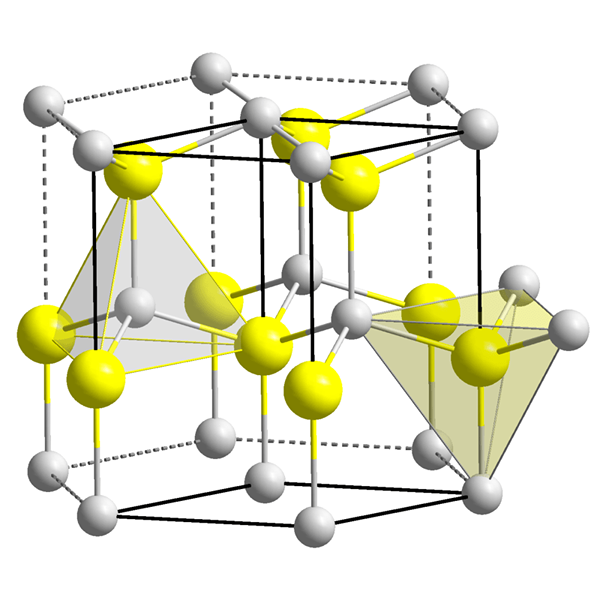
Figura 1: Dos vacíos tetraédricos.
Sin embargo, la forma del vacío tetraédrico no es tetraédrico, solo la disposición de cuatro partículas alrededor del vacío es tetraédrica. Las formas de los vacíos son muy complicadas. El volumen de un vacío tetraédrico es mucho más pequeño que el de un átomo (o esfera) que causa la formación del vacío. Mayor el tamaño de las partículas alrededor del vacío, más grande del tamaño del vacío. El número de coordinación del vacío tetraédrico es cuatro. Aquí, el término número de coordinación representa el número de átomos o iones que rodean inmediatamente el vacío. En el sistema de cristal, hay dos vacíos por esfera (átomo). Estos vacíos y sus tamaños tienen una gran influencia en las propiedades del material.
¿Qué son los vacíos octaédricos??
Los vacíos octaédricos son espacios vacíos desocupados y vacíos presentes en sustancias que tienen sistemas de cristal octaédricos. Se forma un vacío octaédrico entre seis átomos (o esferas). Allí, tres átomos (o esferas) estrechamente empaquetados forman un triángulo equilibrado y se colocan sobre los otros tres átomos, causando que se forme un vacío. Aquí, también hay dos capas atómicas involucradas en la formación del vacío.
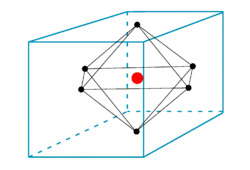
Figura 2: Un vacío octaédrico en el centro de la celda unitaria.
El volumen de un vacío octaédrico es muy pequeño en comparación con un vacío tetraédrico. Cuando se considera una celda unitaria de una sustancia (que tiene una disposición octaédrica), hay un vacío octaédrico en el centro de la celda unitaria, y el número de coordinación de este vacío es de seis ya que seis átomos lo rodean. En una red cristalina, hay un vacío por una esfera (o átomo).
¿Cuáles son las similitudes entre los vacíos tetraédricos y octaédricos??
- Ambos son vacíos presentes en las redes de cristal.
- Ambas son más pequeñas que las esferas que acumulan la red de cristal.
¿Cuál es la diferencia entre los vacíos tetraédricos y octaédricos??
Vacío tetraédrico vs octaédrico | |
| Los vacíos tetraédricos están desocupados, espacios vacíos presentes en sustancias que tienen sistemas de cristal tetraédrico. | Los vacíos octaédricos son espacios vacíos desocupados y vacíos presentes en sustancias que tienen sistemas de cristal octaédricos. |
| Sistema de cristal | |
| Los vacíos tetraédricos se pueden encontrar en sustancias que tienen una disposición tetraédrica en su sistema de cristal. | Los vacíos octaédricos se pueden encontrar en sustancias que tienen una disposición octaédrica en su sistema de cristal. |
| Ubicación en la celda unitaria | |
| Se pueden observar vacíos tetraédricos en los bordes de la celda unitaria. | Se pueden observar vacíos octaédricos en el centro de la celda unitaria. |
| Número de coordinación | |
| El número de coordinación del vacío tetraédrico es cuatro. | El número de coordinación del vacío octaédrico es de seis. |
| Número de vacíos en la red de cristal | |
| Hay dos vacíos tetraédricos por esfera en la red de cristal. | Hay un vacío octaédrico por esfera en la red de cristal. |
Resumen - Vacíos tetraédricos vs octaédricos
Los vacíos son espacios vacíos presentes en los sistemas de cristal que surgen debido a las diferentes disposiciones de los átomos. Hay dos tipos principales de vacíos nombrados como vacío tetraédrico y vacío octaédrico. La diferencia entre los huecos tetraédricos y octaédricos es que el vacío tetraédrico es visible en sustancias que tienen sistemas de cristal tetraédrico, mientras que el vacío octaédrico es visible en sustancias que tienen sistemas de cristal octaédricos.
Descargue los Voides PDF Tetrahédricos vs octaédricos
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según la nota de cita. Descargue la versión PDF aquí Diferencia entre vacíos tetraédricos y octaédricos
Referencia:
1.Maramandansubu sigue. "Vacíos en cristales."LinkedIn Slideshare, 16 de junio de 2013. Disponible aquí
2."Vacío tetraédrico y vacío octaédrico."StudyLayer.com, 12 mar. 2016. Disponible aquí
Imagen de cortesía;
1.'Wurtzite poliedra' por estado sólido - trabajo propio, (dominio público) a través de Commons Wikimedia
2.'Campo de cristal octaédrico'.Wormer - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia


