Diferencia entre el óxido de titanio y el dióxido de titanio

El diferencia clave entre el óxido de titanio y el dióxido de titanio es que el El óxido de titanio contiene un anión de oxígeno por un catión de titanio, mientras que el dióxido de titanio contiene dos aniones de oxígeno por catión de titanio.
El titanio es un elemento químico que tiene el símbolo químico Ti y el número atómico 22. Es un metal brillante que se encuentra en la categoría de metales de transición. Como una característica importante, tiene una alta fuerza en comparación con su baja densidad. Este elemento puede tener varios estados de oxidación, pero el estado de oxidación más estable es +4. Hay varios óxidos que puede formar como titanio (II) óxido, óxido de titanio (III) y dióxido de titanio.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el óxido de titanio?
3. ¿Qué es el dióxido de titanio?
4. Comparación de lado a lado: óxido de titanio vs dióxido de titanio en forma tabular
5. Resumen
¿Qué es el óxido de titanio??
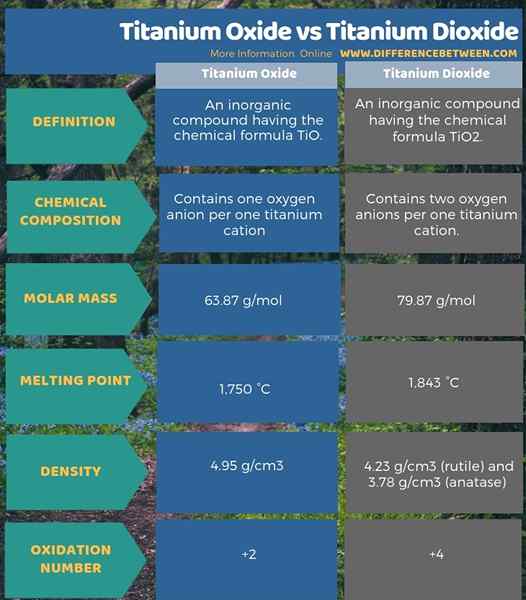
El óxido de titanio es un compuesto inorgánico que tiene la fórmula química. Nombre este compuesto como óxido de monóxido de titanio o titanio (II). La masa molar de este compuesto es 63.87 g/mol. Aparece como cristales de bronce. Además, tiene un alto punto de fusión que es de 1.750 ° C, y la densidad es 4.95 g/cm3. Al considerar la estructura cristalina de este compuesto, tiene una estructura cúbica.
Podemos preparar este compuesto a partir de dióxido de titanio o de metal de titanio también. Pero tenemos que hacer esta reacción a 1500 ° C. Además de eso, las soluciones ácidas de este compuesto son estables por un corto tiempo, pero luego se descompondrá dar hidrógeno. Esta reacción es la siguiente:
2ti2+(aq) + 2h+(aq) → 2ti3+(aq) + h2(gramo)
¿Qué es el dióxido de titanio??
El dióxido de titanio es un compuesto inorgánico que tiene la fórmula química2. Este es el óxido de titanio que ocurre. Además, nombramos este compuesto como óxido de titanio (iv). La masa molar de este compuesto es 79.87 g/mol. Aparece como un sólido blanco. Tiene un punto de fusión alto que es 1.843 ° C. La densidad de este compuesto varía según el tipo de estructura cristalina en la que existe. Por ejemplo, la densidad de la estructura cristalina de rutilo es 4.23 g/cm3 Mientras que la densidad de la estructura cristalina anatasa es 3.78 g/cm3.

Figura 01: Dióxido de titanio sólido
Podemos producir este compuesto al procesar arena de titanio como arena mineral de ilmenita. Al considerar las principales aplicaciones de este compuesto, incluye la producción de pigmentos de dióxido de titanio que es importante para la producción de pinturas, papel, plásticos, etc.
¿Cuál es la diferencia entre el óxido de titanio y el dióxido de titanio??
El óxido de titanio es un compuesto inorgánico que tiene la fórmula química, mientras que el dióxido de titanio es un compuesto inorgánico que tiene la fórmula química tio2. Por lo tanto, el óxido de titanio contiene un anión de oxígeno por un catión de titanio, pero el dióxido de titanio contiene dos aniones de oxígeno por catión de titanio. Esta es la diferencia clave entre el óxido de titanio y el dióxido de titanio. Además, debido a esta estructura, tienen diferentes masas molares y diferentes puntos de fusión también. Además, el número de oxidación de titanio en cada compuesto es diferente entre sí; El número de oxidación de titanio en óxido de titanio es +2, mientras que el número de oxidación de titanio en dióxido de titanio es +4. Esta es otra diferencia importante entre el óxido de titanio y el dióxido de titanio.
La siguiente infografía tabula la diferencia entre el óxido de titanio y el dióxido de titanio con más detalle.
Resumen -óxido de titanio vs dióxido de titanio
El óxido de titanio y el dióxido de titanio son óxidos importantes del elemento químico de titanio. La diferencia clave entre el óxido de titanio y el dióxido de titanio es que el óxido de titanio contiene un anión de oxígeno por catión de titanio pero, el dióxido de titanio contiene dos aniones de oxígeno por catión de titanio.
Referencia:
1. "Titanio (ii) óxido."Wikipedia, Fundación Wikimedia, 19 de agosto. 2018. Disponible aquí
2. "Dióxido de titanio."Wikipedia, Fundación Wikimedia, 26 de agosto. 2018. Disponible aquí
Imagen de cortesía:
1."Titanium (IV) óxido" por Walkerma en English Wikipedia. (Dominio público) a través de Commons Wikimedia


