Diferencia entre la tonicidad y la osmolaridad
El diferencia clave entre la tonicidad y la osmolaridad es que el La tonicidad mide solo la concentración de solutos no penetrantes a través de una membrana semipermeable mientras La osmolaridad mide la concentración total de solutos penetrantes y no penetrantes.
La osmolaridad es la medida de la presión osmótica de una solución. En términos más simples, es aproximadamente la medida de la cantidad de soluto en la solución. Por el contrario, la tonicidad se refiere a la concentración relativa de partículas de soluto dentro de una célula con respecto a la concentración fuera de la célula. Por lo tanto, tanto la tonicidad como la osmolaridad parecen ser conceptos similares. Sin embargo, hay diferencias que discutiremos en este artículo.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la tonicidad?
3. ¿Qué es la osmolaridad?
4. Comparación de lado a lado - Tonicidad vs osmolaridad en forma tabular
5. Resumen
¿Qué es la tonicidad??
La tonicidad es una medida del gradiente de presión osmótica mediante el potencial de agua de dos soluciones separadas por una membrana semipermeable. Significa; El término tonicidad describe la concentración relativa de la solución solutos I que determina la dirección y el alcance de la difusión. Esta medición es importante para determinar la respuesta de las células que están sumergidas en una solución externa.

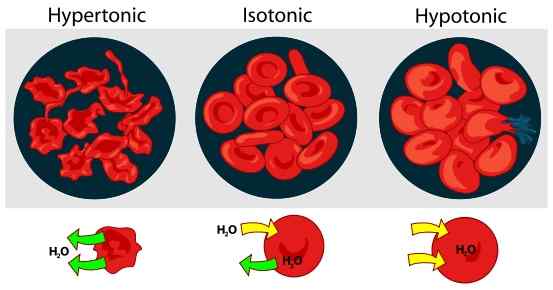
Figura 01: Efecto de la tonicidad en los glóbulos rojos en una solución externa
A diferencia de la presión osmótica, la tonicidad solo está influenciada por solutos que no pueden pasar a través de la membrana. Los solutos que pueden pasar libremente por la membrana no tienen influencia en la tonicidad. Es porque la concentración de estos solutos siempre seguirá siendo la misma en ambos lados de la membrana. Por lo general, expresamos la tonicidad con respecto a otra solución. En consecuencia, hay tres tipos de soluciones basadas en la tonicidad; Soluciones hipertónicas, soluciones hipotónicas y soluciones isotónicas. Las soluciones hipertónicas tienen una alta concentración de soluto que otra solución, mientras que la solución hipotónica tiene una concentración de soluto más baja. Una solución se convierte en isotónica si la concentración efectiva de osmole de esa solución es la misma que la de otra solución.
¿Qué es la osmolaridad??
La osmolaridad o la concentración osmótica es una medida de la concentración de soluto dada por la unidad osmoles de solutos por litro de solución. Podemos denotar la unidad como OSM/L. Del mismo modo, podemos usar este valor para medir la presión osmótica de una solución. Por lo tanto, la tonicidad de la solución también. La ecuación que podemos usar para medir este parámetro es la siguiente:
Osmolaridad = ∑ψinorteiCi
Aquí, ψ es el coeficiente osmótico, n es el número de partículas en las que se disocia una molécula, y C es la concentración molar del soluto. Del mismo modo, hay tres tipos de soluciones según la osmolaridad; isosmótico, hiperosmótico e hipoosmótico.
¿Cuál es la diferencia entre la tonicidad y la osmolaridad??
Los términos tonicidad y osmolaridad están relacionados pero conceptos distintos. La razón por la que están relacionados entre sí es que ambos términos comparan las concentraciones de soluto de dos soluciones separadas de una membrana semipermeable. Estos términos difieren entre sí de acuerdo con el tipo de soluto que tienen en cuenta al medir. Por lo tanto, la diferencia clave entre la tonicidad y la osmolaridad es que la tonicidad mide solo la concentración de solutos no penetrantes a través de una membrana semipermeable, mientras que la osmolaridad mide la concentración total de solutos penetrantes y no penetrantes.
La siguiente infografía da más datos sobre la diferencia entre la tonicidad y la osmolaridad.

Resumen -Tonicidad vs osmolaridad
Los términos osmolaridad y tonicidad están interrelacionados ya que ambos términos comparan las concentraciones de soluto en una solución. Pero, al mismo tiempo, los términos son conceptos químicos distintos de acuerdo con los tipos de solutos que tienen en cuenta en sus medidas. Por lo tanto, la diferencia clave entre la tonicidad y la osmolaridad es que la tonicidad mide solo la concentración de solutos no penetrantes a través de una membrana semipermeable, mientras que la osmolaridad mide la concentración total de solutos penetrantes y no penetrantes.
Referencia:
1. "Tonicidad."Wikipedia, Fundación Wikimedia, 8 de febrero. 2018. Disponible aquí
2. "Concentración osmótica."Wikipedia, Fundación Wikimedia, 15 de octubre. 2018. Disponible aquí
Imagen de cortesía:
1."Diagrama de presión osmótica sobre las células sanguíneas" por Ladyofhats - Trabajo propio (dominio público) a través de Commons Wikimedia


