Diferencia entre la topoisomerasa I y II
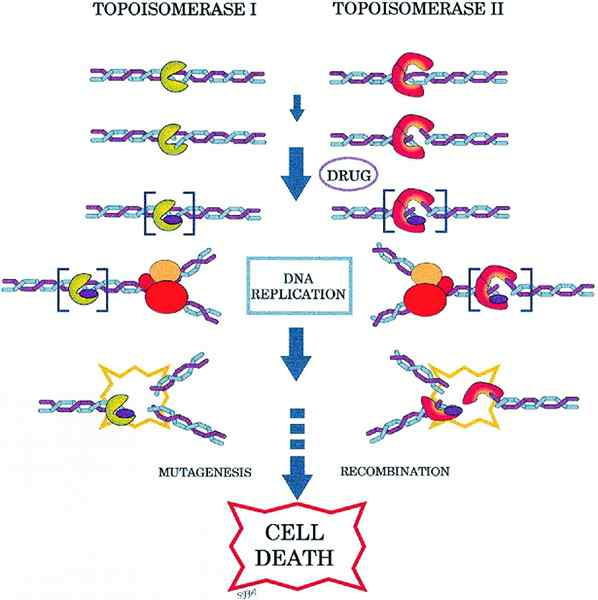
Diferencia clave: topoisomerasa I VS II
El ADN es necesario por una célula para dividirse en dos células hija por división celular. El ADN se duplica mediante replicación de ADN. Por lo tanto, debe haber un mecanismo especial para replicar el ADN en espiral altamente herido. La topoisomerasa es una enzima que puede cortar el ADN en un punto particular y desentrañar el giro de ADN y alivia la naturaleza de ADN SuperCoil. Es la enzima la que participa en el bobinado y desenrollando el ADN. El problema de devanado del ADN se plantea debido a la estructura entrelazada del ADN de doble cadena. Estos tipos de problemas topológicos creados en los hilos duplicados de ADN pueden ser corregidos por topoisomerasas. Por lo general, cortan la columna vertebral de fosfato de ADN, uno o ambos hilos y permiten que la estructura de superenrización de ADN se rompa. Más tarde, la columna vertebral de ADN se vuelve a sellar. Las topoisomerasas bacterianas y humanas tienen mecanismos similares. Topoisomerasa I y II son métodos para tratar con ADN superenrolado. Topoisomerasa I corta un hilo en el ADN doble cadena y no se requiere ATP para su función. Por otro lado, la topoisomerasa, II corta ambas hilos en el ADN y necesita ATP para su actividad. Este es el diferencia clave entre topoisomerasa I y II.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la topoisomerasa?
3. ¿Qué es la topoisomerasa II?
4. Similitudes entre topoisomerasa I y II
5. Comparación de lado a lado - Topoisomerasa I vs II en forma tabular
6. Resumen
¿Qué es la topoisomerasa??
La topoisomerasa I es una clase de enzima que implica la regulación del supercinete de ADN. Manejan el SuperCoiling en el ADN creando descansos monocatenarios y relegando los hilos de ADN. Su papel es muy importante para la replicación y la transcripción de ADN. Se subdividen además en el tipo IA y el tipo IB. Las topoisomerasas de tipo IA se denominan topoisomerasas procariotas I. Por otro lado, las topoisomerasas tipo IB se denominan topoisomerasas eucariotas I. Tipo IA y Tipo IB Las topoisomerasas son funcionalmente diferentes. La topoisomerasa procariota solo puedo revivir los supercoils de ADN negativos. Y la topoisomerasa eucariota puedo introducir superenetas de ADN positivas, también separan el ADN del cromosoma hija después de la replicación y relajan este ADN.

Figura 01: Topoisomerasa I y II
El E. coli La topoisomerasa I es una holoenzima con tres átomos de Zn (II) en los motivos de tetracsteína cerca de su terminal carboxi. Tiene 97 kDa de peso. Topoisomerasa I tiene varias características inusuales. No necesita hidrolizar ATP para catalizar el reordenamiento topológico del ADN. La característica de salida de la topoisomerasa I es, es un monómero completamente funcional, mientras que la mayoría de las enzimas que involucran los reordenamientos topológicos de ADN complejos son de naturaleza oligomérica.
¿Qué es la topoisomerasa II??
Para administrar los enredos de ADN y los supercoils, la topoisomerasa tipo II corta ambos hilos de ADN simultáneamente. Necesitan hidrolizar ATP para esta actividad. Cambio de topoisomerasa tipo II El número de enlace de ADN circular por ± 2. Se clasifican ampliamente en dos categorías, a saber, Tipo II A y Tipo IIB.
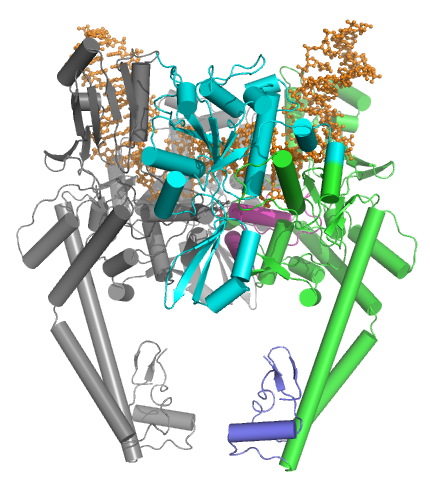
Figura 02: Topoisomerasa II
Tipos II A Las topoisomerasas incluyen ADN girasa bacteriana, topoisomerasa eucariota II, eukaryal viral topoisomerasa alfa y beta y topoisomerasa IV. Tipos II B Las topoisomerasas incluyen topoisomerasa VI que se encuentra en arquea y topoisomerasa VI que se encuentra en plantas superiores. La función de la topoisomerasa II es cortar ambas hilos de una doble hélice de ADN y pasa otra hélice de ADN ininterrumpida a través de ella. Finalmente, los extremos cortados se relegan nuevamente. Las moléculas inhibidoras para la topoisomerasa II se pueden encontrar como, Hu-331, ICRF-193 y mitindomida.
¿Cuáles son las similitudes entre la topoisomerasa I y II??
- Ambas son enzimas están involucradas en el alivio de los superenruz.
- Ambos se encuentran en organismos procariotas, así como en organismos eucariotas.
- Tanto las funciones de topoisomerasa I y II son muy importantes para mantener la replicación y la transcripción de ADN adecuadas en la célula viva.
- Ambos son de naturaleza de proteínas.
¿Cuál es la diferencia entre la topoisomerasa I y II??
Topoisomerasa I vs topoisomerasa II | |
| La topoisomerasa tipo I es una enzima que cambia el grado de superenrollamiento del ADN al causar descansos y descenso de cadena única. | La topoisomerasa tipo II es una enzima que cambia el grado de superenrollamiento del ADN al causar la ruptura y el descenso de cadenas dobles. |
| Hidrolizado de ATP | |
| Topoisomerasa I no necesita hidrolizar ATP para su función. | La topoisomerasa II debe necesitar hidrolizar ATP para su función. |
| ADN rompiendo | |
| Topoisomerasa I hace descansos de una sola cadena. | Topoisomerasa II se rompen dobles hilos. |
| Estructura | |
| Topoisomerasa I es un monómero. | Topoisomerasa II es un heterodímero. |
| Cambiar el número de enlace de ADN circular | |
| La topoisomerasa I está cambiando el número de enlace de ADN circular por unidades de Strictly 1 o por múltiplos de 1 (n). | La topoisomerasa II está cambiando el número de enlace de ADN circular por unidades de ± 2. |
Resumen -Topoisomerasa I VS II
Las topoisomerasas son las enzimas que están involucradas en el devanado o el relajado del ADN. Alivian los supercoils de ADN y facilitan la replicación y la transcripción de ADN. Estas enzimas se pueden encontrar en casi todos los organismos como; humanos, bacterias, plantas superiores, otras bacterias y arquea. Los reordenamientos de ADN topológicos se realizan por topoisomerasas. El hidrolizado de ATP no es necesario para la función de la topoisomerasa I. Topoisomerasa I corta una sola hebra en el ADN. Por otro lado, la topoisomerasa II corta ambas hebras en el ADN y necesita ATP para su función o actividad. Más tarde, estos cortes en la columna vertebral de ADN se vuelven a sellar nuevamente. Las topoisomerasas bacterianas y humanas tienen mecanismos similares en la naturaleza. Esta es la diferencia entre la topoisomerasa I y II.
Descargue la versión PDF de Topoisomerasa I VS II
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según la nota de cita. Descargue la versión PDF aquí Diferencia entre topoisomerasa I y II
Referencia:
1.Topoisomerasa I. Disponible aquí
2."Tipo II de topoisomerasa."Wikipedia, Fundación Wikimedia, 6 de noviembre. 2017. Disponible aquí
3."Tipo I Topoisomerasa."Wikipedia, Fundación Wikimedia, 28 de noviembre. 2017. Disponible aquí
Imagen de cortesía:
1.'Inhibidor de topoisomerasa' por VTVU - trabajo propio, (CC BY -SA 3.0) a través de Commons Wikimedia
2.'2RGR' por Coachwd en el inglés Wikipedia, (CC By-SA 3.0) a través de Commons Wikimedia


