Diferencia entre el fosfato trisódico y el fosfato de tripotasio
El diferencia clave entre el fosfato de trisodio y el fosfato de tripotassium es que El fosfato del trisodio tiene tres sodiumcaciones asociadas con un anión fosfato, mientras que el fosfato de tripotasio tiene tres cationes de potasio asociados con un anión fosfato. Además, la diferencia entre el fosfato de Trisodium y el fosfato de Tripotassium en apariencia es que el fosfato de Trisodium aparece como gránulos blancos, mientras que el fosfato de Tripotassium aparece como un polvo delicuescente blanco.
Trisodium fosfato y fosfato de tripotasio son sales iónicas que tienen cationes y aniones asociados entre sí. Estos aniones atraen cationes a través de interacciones electrostáticas. El anión de estos dos compuestos es el anión fosfato (PO43-). Es un anión tribásico que es capaz de sostener tres cationes con él.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el trisodium fosfato?
3. ¿Qué es el fosfato de Tripotassium?
4. Comparación de lado a lado: fosfato de trisodio vs fosfato de tripotasio en forma tabular
5. Resumen
¿Qué es el trisodium fosfato??
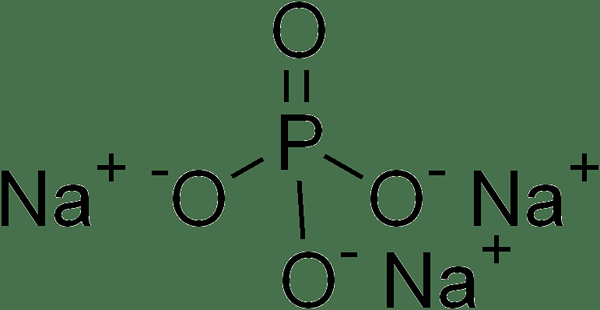
Trisodium fosfato es una sal iónica que tiene la fórmula química na3correos4. Por lo tanto, es un compuesto inorgánico. Aparece como gránulos blancos y es muy soluble en agua. Además, cuando disolvemos este compuesto en agua, forma una solución alcalina. La masa molar de este compuesto es 163.94 g/mol. Su punto de fusión es de 1.583 ° C, y se descompone a temperaturas más altas.

Figura 01: Estructura química del fosfato de Trisodium
Además, este compuesto es útil como agente de limpieza, constructor, lubricante, aditivo alimentario, removedor y desgrasador. Podemos producir este compuesto mediante la neutralización del ácido fosfórico usando hidróxido de sodio junto con carbonato de sodio. Sin embargo, si usamos carbonato de sodio solo, solo dará el fosfato del disódico.
¿Qué es el fosfato de Tripotassium??
El fosfato de Tripotassium es una sal iónica que tiene la fórmula química K3correos4. Es un compuesto inorgánico. Además, esta sal es soluble en agua y ligeramente higroscópica también. Aparece como un polvo delicuescente blanco. La masa molar de este compuesto es 212.27 g/mol Si bien el punto de fusión es de 1.380 ° C, y a altas temperaturas, se descompone fácilmente. Podemos encontrarlo como cristales, grumos o como polvo.
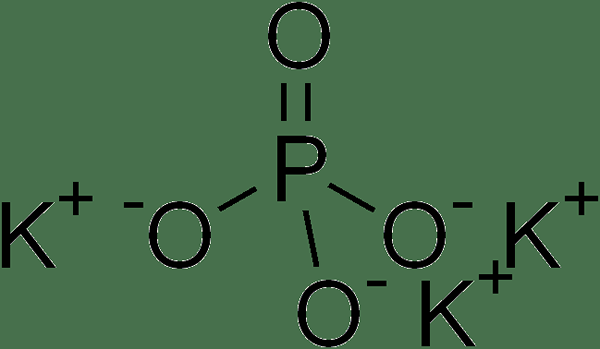
Figura 02: Estructura química del fosfato de Tripotassium
El uso principal de este compuesto es usar como catalizador para reacciones químicas. Además, podemos usarlo como un aditivo alimentario porque puede actuar como emulsionante, agente de espuma y agente de azotes. Podemos producir este compuesto a través de la reacción entre el fosfato de amonio y el cloruro de potasio.
¿Cuál es la diferencia entre el fosfato trisodium y el fosfato de tripotasio??
Trisodium fosfato es una sal iónica que tiene la fórmula química na3correos4. La masa molar de este compuesto es 163.94 g/mol. Además, aparece como gránulos blancos. Por otro lado, el fosfato de Tripotassium es una sal iónica que tiene la fórmula química K3correos4. La masa molar de este compuesto es 212.27 g/mol. Además, aparece como un polvo delicuescente blanco. Este es el
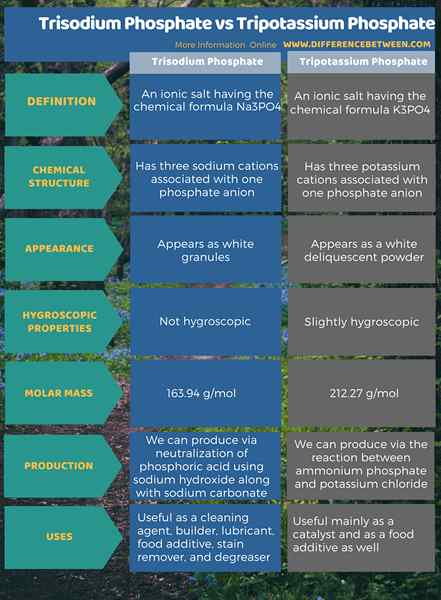
Resumen -Trisodium fosfato vs fosfato de tripotasio
Tanto el fosfato de trisodio como el fosfato de Tripotassium son sales iónicas inorgánicas. La diferencia entre el fosfato de trisódico y el fosfato de tripotasio es que el fosfato de trisodio tiene tres cationes de sodio asociados con un anión fosfato, mientras que el fosfato de tripotasio tiene tres cationes de potasio asociados con un anión fosfato.
Referencia:
1. "Fosfato trisódico."Wikipedia, Fundación Wikimedia, 9 de julio de 2018. Disponible aquí
2. "Tripotassium fosfato."Wikipedia, Fundación Wikimedia, 3 de julio de 2018. Disponible aquí
Imagen de cortesía:
1.'Trisodium Phosfate'by Edgar181 - Trabajo propio, (dominio público) a través de Commons Wikimedia
2.'Tripotassium fosfato'by Edgar181 - Trabajo propio, (dominio público) a través de Commons Wikimedia


