Diferencia entre electrolito verdadero y potencial
El diferencia clave entre el electrolito verdadero y potencial es que Los verdaderos electrolitos se disocian en iones completamente, mientras que los electrolitos potenciales se disocian en iones parcialmente.
Podemos clasificar todos los compuestos en dos grupos como electrolitos y no electrolitos, dependiendo de su capacidad para producir iones y realizar electricidad. La electrólisis es el proceso de pasar una corriente a través de una solución electrolítica y forzar iones positivos y negativos para avanzar hacia sus respectivos electrodos. Los no electrolitos no pueden participar en los procesos de electrólisis.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es verdadero electrolito?
3. ¿Qué es el electrolito potencial?
4. Comparación de lado a lado: electrolito verdadero vs potencial en forma tabular
5. Resumen
¿Qué es verdadero electrolito??
Los verdaderos electrolitos son la sustancia que puede disociarse por completo en sus iones. Estos también se nombran como electrolitos fuertes. Estos compuestos producen fácilmente sus formas iónicas cuando se disuelven en agua u otra solución. Hay tanto cationes como aniones en la solución después de disociarse el compuesto; Por lo tanto, estos iones pueden transportar corriente eléctrica a través de la solución electrolítica. Esta es la razón de su nombre "Electrolito", que significa "capacidad para realizar electricidad".
Una solución concentrada de un electrolito verdadero tiene una presión de vapor baja que el agua pura a una temperatura similar. Los ácidos fuertes, las bases fuertes, las sales iónicas solubles que no son ácidos y bases débiles pueden clasificarse como electrolitos verdaderos.

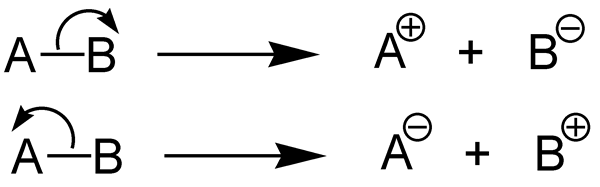
Figura 01: Disociación completa
Al escribir la reacción química para la ionización de un electrolito verdadero, podemos usar una sola flecha en una dirección para mostrar la reacción de ionización completa en contraste con los electrolitos potenciales o débiles. Esta sola flecha significa que la reacción ocurre por completo. Los verdaderos electrolitos pueden conducir la electricidad solo cuando estén fundidos o en las soluciones. Dado que la ionización es alta, el voltaje que puede producir un verdadero electrolito es muy alto.
¿Qué es el electrolito potencial??
Los electrolitos potenciales son las sustancias que pueden disociarse parcialmente en sus iones. Esto significa que no puede disociarse completamente en sus iones en una solución acuosa. Por lo tanto, la solución acuosa de un electrolito potencial contendrá tanto especies iónicas como moléculas no disociadas. Por lo general, la disociación de un electrolito potencial es de aproximadamente 1-10%. Estos también se nombran como electrolitos débiles. Algunos ejemplos comunes de electrolitos débiles incluyen ácido acético, ácido carbónico, amoníaco, ácido fosfórico, etc. Estos son ácidos débiles o bases débiles.
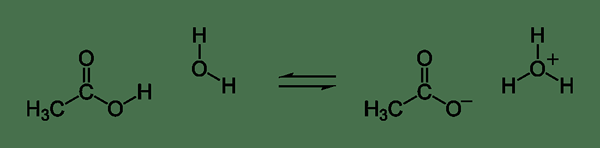
Figura 02: Reacción química para la disociación del ácido acético
Al escribir la reacción química para la disociación de un electrolito débil, usamos dos medias flechas que se dirigen a direcciones opuestas. Esta flecha significa que existe un equilibrio entre las especies iónicas y las moléculas sindicalizadas en la solución acuosa.
¿Cuál es la diferencia entre electrolito verdadero y potencial??
Dependiendo de su capacidad para producir iones y realizar electricidad, podemos clasificar todos los compuestos en dos grupos como electrolitos y no electrolitos. Los electrolitos nuevamente se dividen en dos partes como electrolitos verdaderos y potenciales. La diferencia clave entre el electrolito verdadero y potencial es que los electrolitos verdaderos se disocian en iones por completo, mientras que los electrolitos potenciales se disocian en iones parcialmente. Además, la resistencia a la disociación de los electrolitos verdaderos es del 100%, mientras que la resistencia a la disociación de los electrolitos potenciales varía de 1 a 10%.
La siguiente tabla resume la diferencia entre el electrolito verdadero y potencial.
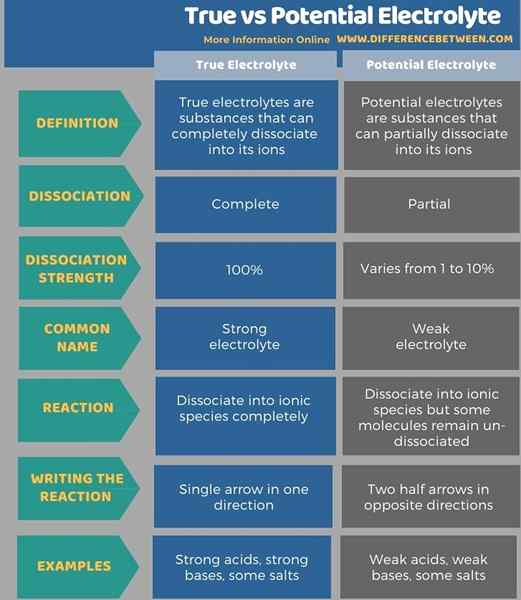
Resumen: verdadero electrolito potencial vs potencial
Los verdaderos electrolitos son la sustancia que puede disociarse completamente en sus iones, mientras que los electrolitos potenciales son las sustancias que pueden disociarse parcialmente en sus iones. Por lo tanto, la diferencia clave entre el electrolito verdadero y potencial es que los electrolitos verdaderos se disocian por completo en iones, mientras que los electrolitos potenciales se disocian en iones parcialmente.
Referencia:
1. Helmenstine, Todd. “Definición y ejemplos de electrolitos débiles."Thinkco, febrero. 11, 2020, disponible aquí.
Imagen de cortesía:
1. "Heterólisis (química)" de Jürgen Martens (CC By-SA 3.0) a través de Commons Wikimedia
2. "ACETIC-ACID-DISSOCiation-2D" por Ben Mills-Trabajo propio (dominio público) a través de Commons Wikimedia


