Diferencia entre tripsina y quimotripsina
Diferencia de clave: trypsin VS quymotripsina
La digestión de proteínas es un proceso muy importante en el procedimiento general de digestión en los organismos vivos. Las proteínas complejas se digieren en sus monómeros de aminoácidos y se absorben a través del intestino delgado. Las proteínas son esenciales, ya que sirven un papel importante funcional y estructural en un organismo. La digestión de proteínas se lleva a cabo a través de enzimas de digerencia de proteínas que incluyen tripsina, quimotripsina, peptidasas y proteasas. La tripsina es una enzima que diga proteínas que corta el enlace peptídico en los aminoácidos básicos que incluyen lisina y arginina. La quimotripsina también es una enzima que diga proteínas que escinde el enlace péptido en aminoácidos aromáticos como la fenilalanina, el triptófano y la tirosina. El diferencia clave Entre la tripsina y la quimotripsina se encuentra la posición del aminoácido en la que se escinde en la proteína. La tripsina se escinde en posiciones básicas de aminoácidos, mientras que la quimotripsina se escinde en posiciones de aminoácidos aromáticos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la tripsina?
3. ¿Qué es quymotripsin?
4. Similitudes entre tripsina y quimotripsina
5. Comparación lado a lado: tripsina vs quimotripsina en forma tabular
6. Resumen
¿Qué es la tripsina??
La tripsina es un 23.Proteína de 3 kDa que pertenece a la familia de serina proteasas y sus principales sustratos son aminoácidos básicos. Estos aminoácidos básicos incluyen arginina y lisina. La tripsina fue descubierta en 1876 por Kuhne. La tripsina es una proteína globular y existe en su forma inactiva, que es tripsinógeno - zymogen. El mecanismo de acción de la tripsina se basa en la actividad de la serina proteasa.
La tripsina se escinde en el extremo del terminal C de los aminoácidos básicos. Esta es una reacción de hidrólisis y tiene lugar a un pH - 8.0 en el intestino delgado. La activación del tripsinógeno tiene lugar a través de la eliminación del hexapéptido terminal, y produce la forma activa; tripsina. La tripsina activa es de dos tipos principales; α - tripsina y β -tripsina. Difieren en su estabilidad térmica y su estructura. El sitio activo de la tripsina contiene histidina (H63), ácido aspártico (D107) y serina (S200).
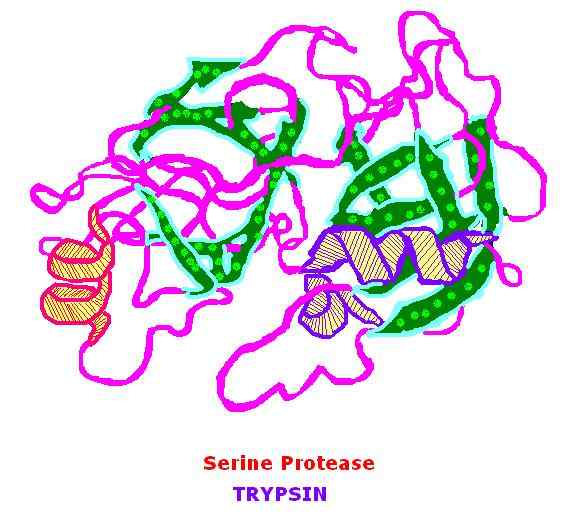
Figura 01: Trypsin
La acción enzimática de la tripsina es inhibida por DFP, aprotinina, AG+, Benzamidina y edta. Las aplicaciones de la tripsina incluyen disociación de tejido, tripsinización en cultivo de células animales, mapeo tríptico, in vitro Estudios de proteínas, huellas digitales y aplicaciones de cultivo de tejidos.
¿Qué es quymotripsin??
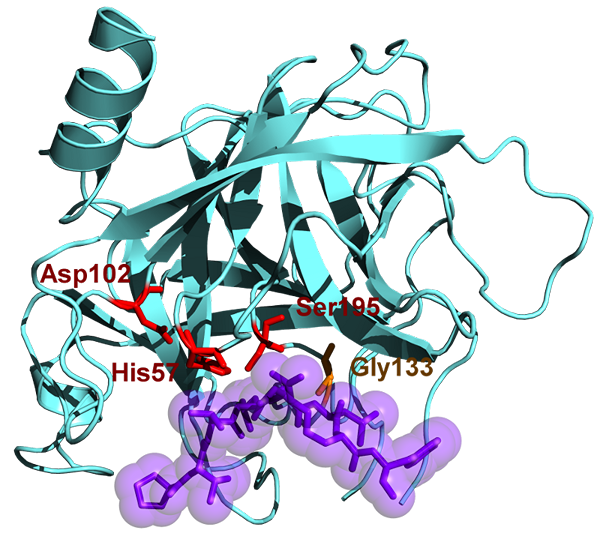
La quimotripsina tiene un peso molecular de 25.6 kDa y pertenece a la familia serina proteasa, y es una endopeptidasa. La quimotripsina existe en su forma inactiva que es quimotripsinógeno. La quimotripsina fue descubierta en el año 1900s. La quimotripsina hidroliza los enlaces peptídicos en los aminoácidos aromáticos. Estos sustratos aromáticos incluyen tirosina, fenilalanina y triptófano. Los sustratos de esta enzima se encuentran principalmente en los isómeros L y actúan fácilmente sobre las amidas y los ésteres de los aminoácidos. El pH óptimo en el que actúa la quimotripsina es 7.8 - 8.0. Hay dos formas principales de quimotripsina, como la quimotripsina A y la quimotripsina B, y difieren ligeramente en las características estructurales y proteolíticas. El sitio activo de quimotripsina contiene una tríada catalítica y está compuesto por histidina (H57), ácido aspártico (D102) y serina (S195).

Figura 02: quimotripsina
Los activadores de la quimotripsina son bromuro de cetiltrimetilamonio, bromuro de dodeciltrimetilamonio, bromuro de hexadeciltrimetilamonio y tetrabutilamonio. Los inhibidores de la quimotripsina son peptidil aldehídos, ácidos borónicos y derivados de cumarina. La quimotripsina se usa comercialmente en síntesis de péptidos, mapeo de péptidos y huellas dactilares de péptidos.
¿Cuáles son las similitudes entre la tripsina y la quimotripsina??
- Ambas enzimas son serina proteasas.
- Ambas enzimas escinden enlaces peptídicos.
- Ambas enzimas actúan en el intestino delgado.
- Ambas enzimas existen en su forma inactiva como zymógenos.
- Ambas enzimas están compuestas por una tríada catalítica que contiene histidina, ácido asparto y serina en su sitio activo.
- Ambas enzimas fueron descubiertas inicialmente y extraídas del ganado.
- La producción de ambas enzimas se realiza a través de técnicas de ADN recombinantes actualmente.
- Ambas enzimas actúan en un pH básico óptimo.
- Ambas enzimas se usan in vitro En diferentes industrias.
¿Cuál es la diferencia entre tripsina y quimotripsina??
Tripsina vs quimotripsina | |
| La tripsina es una enzima que diga proteínas que escindirá el enlace péptido en los aminoácidos básicos como la lisina y la arginina. | La quimotripsina, que también es una enzima que diga proteínas, escinde el enlace péptido en aminoácidos aromáticos como la fenilalanina, el triptófano y la tirosina. |
| Peso molecular | |
| El peso molecular de la tripsina es 23.3 k da. | El peso molecular de la quimotripsina es de 25.6 k da. |
| Sustratos | |
| Las proteínas complejas se digieren en sus monómeros de aminoácidos y se absorben a través del intestino delgado. | Los sustratos de aminoácidos aromáticos como la Ley de tirosina, triptófano y fenilalanina sobre quimotripsina. |
| Forma zymogen de la enzima | |
| Tripsinógeno es la forma inactiva de tripsina. | El quimotripsinógeno es la forma inactiva de quimotripsina. |
| Activadores | |
| Los lantánidos son activadores de la tripsina. | Bromuro de cetiltrimetilamonio, bromuro de dodeciltrimetilamonio, bromuro de hexadeciltrimetilamonio y bromuro de tetrabutilamonio son activadores de quimotripsina. |
| Inhibidores | |
| DFP, Aprotinina, AG+, Benzamidina y EDTA son inhibidores de la tripsina. | Los aldehídos de peptidilo, los ácidos borónicos y los derivados de la cumarina son inhibidores de la quimotripsina. |
Resumen -Trypsin VS quymotripsina
Las peptidasas o las enzimas proteolíticas escinden proteínas a través de la hidrólisis del enlace peptídico. La tripsina escinde el enlace péptido en aminoácidos básicos, mientras que la quimotripsina escinde el enlace péptido en residuos de aminoácidos aromáticos. Ambas enzimas son serina peptidasas y actúan en el intestino delgado en un entorno de pH básico. En la actualidad, hay mucha investigación involucrada en la producción de tripsina y quimotripsina utilizando tecnología de ADN recombinante mediante el uso de diferentes especies bacterianas y fúngicas, ya que estas enzimas poseen un alto valor industrial. Esta es la diferencia entre tripsina y quimotripsina.
Descargue la versión PDF de Trypsin vs Chymotrypsin
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según la nota de cita. Descargue la versión PDF aquí Diferencia entre tripsina y chymotryphrypsin
Referencia:
1."Quymotripsina."Manual de enzimas de Worthington - Manual de Worthington. Disponible aquí
2."Trypsin."Trypsin - Manual de enzimas de Worthington. Disponible aquí
Imagen de cortesía:
1.'Serine Protease' por Tinaastella en English Wikibooks (dominio público) a través de Commons Wikimedia
2.'Chymotrypsin 4cha'by yikrazuul - trabajo propio, (CC by -sa 3.0) a través de Commons Wikimedia


