Diferencia entre la ubiquitinación y la sumoilación
El diferencia clave Entre la ubiquitinación y la sumailación es que La ubiquitinación es una modificación postraduccional que puede marcar proteínas para la degradación o tener otras funciones acolchadas, mientras que la sumoilación es una modificación postraduccional que no se usa en las células para marcar proteínas para la degradación.
Las modificaciones postraduccionales son modificaciones covalentes y enzimáticas que ocurren después de la síntesis de proteínas. Estas modificaciones regulan las actividades de proteínas. La unión de pequeños grupos químicos, azúcar, lípidos y polipéptidos modifica proteínas. La ubiquitina es el modificador de polipéptidos más conocido. Además, hay varias proteínas similares a la ubiquitina. Pequeño modificador relacionado con la ubiquitina (Sumo) es uno de esos modificadores. Por lo tanto, la ubiquitinación y la sumoilación son dos modificaciones postraduccionales. La ubiquitinación marca proteínas para la degradación. En contraste, la sumoilación no se usa para marcar proteínas para la degradación. Ambas modificaciones regulan la localización y actividad de las proteínas. Son procesos reversibles.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ubiquitinación?
3. ¿Qué es la sumailación?
4. Similitudes entre ubiquitinación y sumoilación
5. Comparación de lado a lado: ubiquitinación vs sumoilación en forma tabular
6. Resumen
¿Qué es la ubiquitinación??
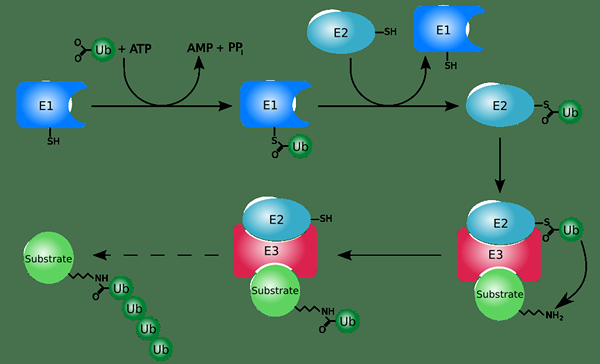
La ubiquitina es un modificador de polipéptidos. Es una pequeña proteína que actúa como una etiqueta molecular en la modificación postraduccional de proteínas. La ubiquitinación es el proceso que utiliza ubiquitina para la modificación postraduccional. Diferentes enzimas catalizan la conjugación covalente de ubiquitina a proteínas. Tiene lugar en presencia de ATP. Las enzimas que catalizan la ubiquitinación son enzimas activadoras de ubiquitina, enzimas conjugadoras de ubiquitina y ligasas ubiquitinas.

Figura 01: ubiquitinación
La ubiquitinación juega un papel importante en la orientación de las proteínas para la degradación proteolítica. Además, la ubiquitinación también puede regular la localización y actividad de las proteínas. Este proceso puede revertirse a través de la acción de las enzimas de deubiquitinasa.
¿Qué es la sumailación??
SUMOLATION es otra modificación postraduccional que utiliza pequeños modificadores similares a la ubiquitina (SUMOS). La unión covalente de sumos altera la estructura y la función de la proteína. SUMOYLACIÓN modifica covalentemente una gran cantidad de proteínas involucradas en muchos procesos celulares, incluida la expresión génica, la estructura de la cromatina, la transducción de señales y el mantenimiento del genoma.
Figura 02: proteína de sumo
La sumoilación regula la localización de proteínas y la actividad similar a la ubiquitinación. Sin embargo, a diferencia de la ubiquitinación, la sumoilación no etiqueta ni marca las proteínas para la degradación. Similar a la ubiquitinación, la sumoilación es un proceso enzimático que es catalizado por las enzimas.
¿Cuáles son las similitudes entre la ubiquitinación y la sumoilación??
- La ubiquitinación y la sumoilación son dos modificaciones postraduccionales importantes.
- Tanto la sumailación como la ubiquitinación son procesos reversibles.
- Juegan papeles cruciales en funciones biológicas.
- Algunas proteínas pueden ser modificadas por sumo y ubiquitina.
- Ambos procesos alteran la función de la proteína.
- Además, tanto las modificaciones postraduccionales regulan la localización y actividad de las proteínas.
- Requieren una cascada de enzimas.
¿Cuál es la diferencia entre la ubiquitinación y la sumailación??
La ubiquitinación y la sumoilación son dos modificaciones postraduccionales que alteran la función de las proteínas. La ubiquitinación es la conjugación covalente de ubiquitina a proteínas, mientras que la sumoilación es la adición de sumos a las proteínas. Además, la ubiquitinación etiqueta las proteínas para la degradación proteolítica, mientras que la sumoilación no etiqueta las proteínas para la degradación. Por lo tanto, esta es la diferencia clave entre la ubiquitinación y la sumailación.
A continuación, la infografía muestra más detalles de la diferencia entre la ubiquitinación y la sumailación.
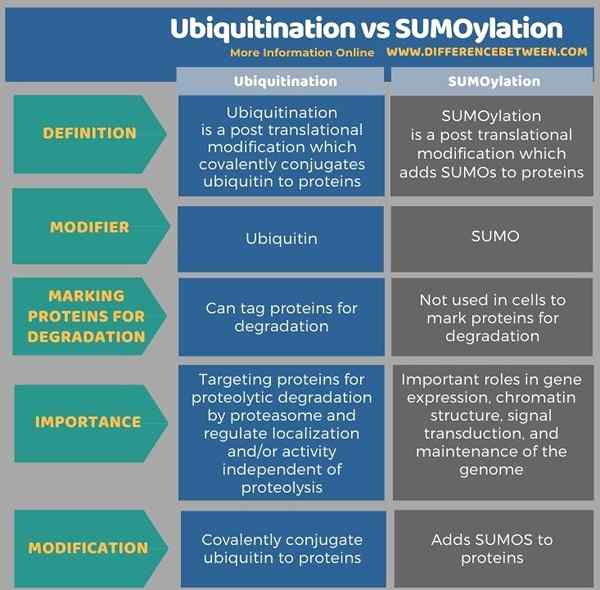
Resumen -ubiquitinación vs sumoilación
La ubiquitinación y la sumoilación son dos modificaciones postraduccionales importantes. Ambos son procesos reversibles catalizados por enzimas. En la ubiquitinación, la ubiquitina es el modificador de polipéptidos mientras está en sumoilación, los sumos son los modificadores. Las ubiquitinas se conjugan covalentemente con proteínas y alteran su estructura y función. Se agregan sumos a proteínas en sumailación. La sumoilación es análoga a la ubiquitilación en términos del esquema de reacción y las clases de enzimas utilizadas. Pero, la ubiquitinación etiqueta las proteínas para la degradación dependiente del proteasoma, mientras que la sumoilación no implica el etiquetado de proteínas para la degradación. Por lo tanto, esta es la diferencia clave entre la ubiquitinación y la sumailación.
Referencia:
1. Gill, Grace. "Sumo y ubiquitina en el núcleo: diferentes funciones, mecanismos similares?"Genes & Development, Cold Spring Harbor Lab, 1 de enero. 1970, disponible aquí.
2. Smith, Yolanda. "Ubiquitinación (ubiquitilación)."Noticias, 23 de agosto. 2018, disponible aquí.
Imagen de cortesía:
1. "Ubiquitilación" de Rogerdodd (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Hsumo1 1A5R Ribas de RNM" de Jakob Suckale en English Wikipedia - Originalmente de EN.Wikipedia (dominio público) a través de Commons Wikimedia


