Diferencia entre reacciones unimoleculares y bimoleculares
Diferencia clave: unimolecular VS reacciones bimoleculares
En química, el término molecularidad se usa para expresar el número de moléculas que se unen para reaccionar en una reacción elemental. Una reacción elemental es una reacción de un solo paso que proporciona el producto final directamente después de la reacción entre reactivos. Esto significa que las reacciones elementales son reacciones químicas que no tienen pasos intermedios antes de la formación del producto final. Las reacciones unimoleculares y bimoleculares son tales reacciones elementales. El diferencia clave entre reacciones unimoleculares y bimoleculares es que Las reacciones unimoleculares implican solo una molécula como reactante, mientras que las reacciones bimoleculares involucran dos moléculas como reactivos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las reacciones unimoleculares?
3. ¿Qué son las reacciones bimoleculares?
4. Similitudes entre reacciones unimoleculares y bimoleculares
5. Comparación lado a lado: reacciones unimoleculares vs bimoleculares en forma tabular
6. Resumen
¿Qué son las reacciones unimoleculares??
Las reacciones unimoleculares son reacciones elementales que implican solo una molécula como reactivo. Allí, la reacción es una reacción de reordenamiento. La sola molécula se reorganiza para formar moléculas más diferentes como productos finales. Pero esto ocurre en un solo paso. No hay pasos intermedios que sufra la molécula reactiva en la formación del producto final. Da directamente los productos finales. La ecuación para la reacción se puede dar como
A → P
Aquí A es reactivo y P es el producto. De acuerdo con el primer orden de la ley de tasa, la tasa de reacción se puede administrar como se muestra a continuación.
Velocidad = k [reactivo]
Algunos ejemplos de reacciones unimoleculares incluyen seguidores:
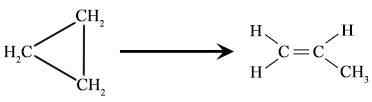
Figura 01: reordenamiento del ciclopropano para formar propano.
- Conversión de n2O4 en dos no2 moléculas
- Conversión de ciclopropano en propeno
- Conversión de PCL5 en PCL3 y CL2
¿Qué son las reacciones bimoleculares??
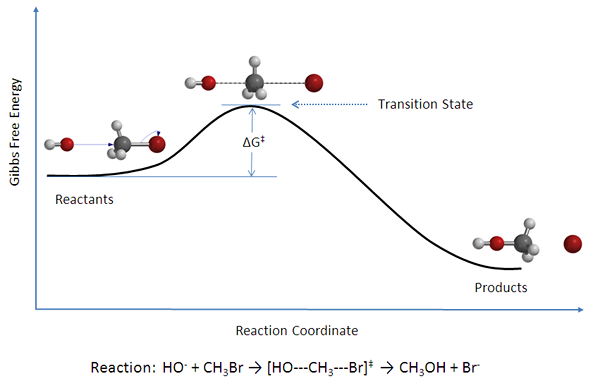
Las reacciones bimoleculares son reacciones químicas elementales que involucran dos moléculas como reactivos. Se puede describir como la colisión de dos moléculas o partículas. Estas son reacciones químicas comunes en química orgánica e inorgánica. Las dos moléculas pueden ser de los mismos o diferentes tipos. Por ejemplo, las dos moléculas pueden ser dos moléculas NOCL con la misma disposición atómica o pueden ser C y O2 tener diferentes combinaciones atómicas. Las ecuaciones para las reacciones bimoleculares se dan a continuación.
A +A → P
A +B → P

Figura 02: Diagrama de energía para una reacción bimolecular.
Dado que hay dos reactivos, estas reacciones se explican como reacciones de segundo orden. Por lo tanto, estas reacciones bimoleculares se describen mediante la ley de tasa de pedido;
Tasa = [a]2
O
Tasa = [a] [b]
En el que el orden general es siempre 2. A continuación se dan algunos ejemplos de reacciones bimoleculares.
- Reacción entre CO y no3
- Reacción entre dos moléculas de NOCL
- Reacción entre cl y ch4
¿Cuáles son las similitudes entre las reacciones unimoleculares y bimoleculares??
- Las reacciones unimoleculares y bimoleculares son reacciones elementales.
- Las reacciones unimoleculares y bimoleculares dan al producto en un solo paso.
- Las reacciones unimoleculares y bimoleculares no tienen pasos intermedios.
¿Cuál es la diferencia entre reacciones unimoleculares y bimoleculares??
Reacciones unimoleculares vs biomoleculares | |
| Las reacciones unimoleculares son reacciones elementales que implican solo una molécula como reactivo. | Las reacciones bimoleculares son reacciones químicas elementales que involucran dos moléculas como reactivos. |
| Reactivos | |
| Las reacciones unimoleculares tienen un reactivo | Las reacciones bimoleculares tienen dos reactivos. |
| Ley de Tarifas de Orden | |
| Las reacciones unimoleculares se explican a través de la ley de primer orden de tasa. | Las reacciones bimoleculares se explican a través de la ley de velocidad de segundo orden. |
| Orden general | |
| El orden general de la ecuación de tasa de reacciones unimoleculares siempre es 1. | El orden general de la ecuación de tasa de reacciones bimoleculares es siempre 2. |
Resumen -Unimolecular VS reacciones bimoleculares
Las reacciones unimoleculares y bimoleculares son reacciones elementales. Estas reacciones dan al producto en un solo paso. Estas reacciones también se pueden expresar mediante leyes de velocidad. La diferencia entre las reacciones unimoleculares y bimoleculares es que las reacciones unimoleculares implican solo un reactivo, mientras que las reacciones bimoleculares involucran dos moléculas como reactivos.
Descargue el PDF de reacciones bimoleculares unimoleculares vs
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según la nota de cita. Descargue la versión PDF aquí: Diferencia entre reacciones unimoleculares y bimoleculares
Referencia:
1."Reacciones elementales."Bibliotecas de química, Librettexts, 26 de mayo de 2017. Disponible aquí
2."Reacción elemental."Wikipedia, Fundación Wikimedia, 10 de febrero. 2018. Disponible aquí
3."Molecularidad."Wikipedia, Fundación Wikimedia, 13 de febrero. 2018. Disponible aquí
Imagen de cortesía:
1.'Izomerización de ciclopropano' por Djokili92 - Trabajo propio, (CC By -SA 4.0) a través de Commons Wikimedia
2.'Rxn Coordinate Diagram 5'by Chem540Grp1f08 - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia


