Diferencia entre la constante de gas universal y la constante de gas característica
Diferencia clave: constante de gas universal vs constante de gas característico
La fase gaseosa es una de las tres fases principales que la materia puede existir. Es el estado más compresible de los tres estados de la materia. Solo existen 11 elementos de otros elementos como gases en condiciones normales. Sin embargo, la "ley de gas ideal" nos da una ecuación que puede usarse para explicar el comportamiento de un gas normal. Tiene una constante de proporcionalidad que se llama constante de gas universal y cuando se aplica a un gas real, esta constante se usa con una modificación. Entonces se llama constante de gas característico. La diferencia clave entre la constante de gas universal y la constante de gas característica es que La constante de gas universal solo es aplicable para gases ideales mientras La constante de gas característica es aplicable para gases reales.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la constante de gas universal?
3. ¿Qué es la constante de gas característica?
4. Comparación de lado a lado: constante de gas universal frente a gas característico constante en forma tabular
5. Resumen
¿Qué es la constante de gas universal??
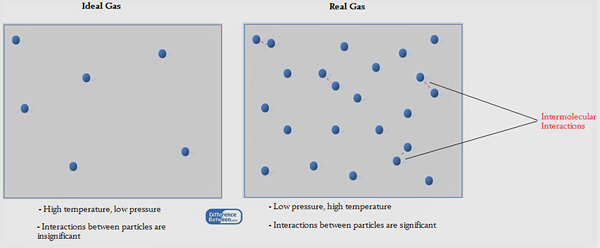
Las moléculas de gas son capaces de movimiento libre en todo el espacio, ya que son moléculas muy ligeras. Las fuerzas entre las moléculas de gas son débiles fuerzas de atracción de van der Waal. Sin embargo, para explicar el comportamiento de un gas, los científicos han derivado teorías utilizando un gas hipotético conocido como gas ideal. También han derivado una ley sobre este gas ideal, que se conoce como la ley de gas ideal.
Primero, debemos saber lo que significa un gas ideal. Es un gas hipotético que mostraría las siguientes propiedades si fuera un gas real. Estos son solo suposiciones.
- Un gas ideal está compuesto por una gran cantidad de pequeñas moléculas de gas.
- El volumen de esas moléculas de gas es insignificante.
- No hay atracciones entre las moléculas de gas.
- El movimiento de estas moléculas de gas obedece la ley de movimiento de Newton.
- Las colisiones de las moléculas son completamente elásticas.
Al observar estas propiedades, es comprensible que ninguno de los gases reales sea ideal.
¿Qué es la ley de gas ideal?
La ley de gas ideal indica el estado de un gas ideal y se explica por una ecuación de la siguiente manera.
PV = NRT
P - Presión del gas ideal
V - volumen del gas ideal
N - Número de lunares del gas ideal (cantidad de sustancia)
T - temperatura
El término R aquí es la constante de gas universal. El valor de R se puede calcular considerando la temperatura y la presión estándar que son 00C y 1atm presión. Esto da un valor para la constante de gas universal como 0.082057 l/(k.mol).
¿Qué es la constante de gas característica??
Al aplicar la ecuación de gas ideal para gases normales, la ecuación anterior requiere modificación porque ninguno de los gases reales se comporta como un gas ideal. Por lo tanto, la constante de gas característica, en lugar de la constante de gas universal, se usa allí. Las propiedades de los gases reales que son diferentes de un gas ideal se pueden enumerar como a continuación.
- Los gases reales están compuestos de moléculas grandes distinguibles en comparación con los gases ideales.
- Estas moléculas de gas tienen cierto volumen.
- Hay fuerzas débiles de Van der Waal entre las moléculas de gas.
- Las colisiones no son completamente elásticas.
Por lo tanto, la ley de gas ideal no se puede aplicar directamente a un gas real. Por lo tanto, se realiza una modificación simple; La constante de gas universal se divide por la masa molar del gas antes de aplicarla en la ecuación. Se puede mostrar de la siguiente manera.
Riñonalespecífico = R/M
Riñonalespecífico - Constante de gas característico
R - constante de gas universal
M- masa molar del gas
Esto se puede usar incluso para una mezcla de gases. Entonces, la constante R debe dividirse por la masa molar de la mezcla de gases. Esta constante de gas característica también se conoce como la específico constante de gas porque su valor depende del gas o la mezcla de gases.

Figura 01: Gas ideal frente a gas real
¿Cuál es la diferencia entre la constante de gas universal y la constante de gas característica??
Constante de gas universal vs constante de gas característico | |
| La constante de gas universal solo se aplica para un gas ideal. | La constante de gas característica se aplica para un gas real. |
| Cálculo | |
| La constante de gas universal se calcula utilizando valores de temperatura y presión estándar (STP). | La constante de gas característica se calcula con valores STP junto con la masa molar del gas real. |
| Relación con el gas | |
| La constante de gas universal es independiente del gas tomado. | La constante de gas característica depende del gas. |
| Valor | |
| El valor de la constante de gas universal es 0.082057 l/(k.mol). | El valor para la constante de gas característica siempre dependerá del gas. |
Resumen -Constante de gas universal vs constante de gas característico
Un gas ideal es un gas hipotético que se supone que tiene propiedades que son muy diferentes de un gas real. La ley de gas ideal se forma para explicar el comportamiento de un gas ideal. Sin embargo, al usar esta constante en gases reales, debe modificarse aplicando una constante de gas característica que no sea la constante de gas universal. Eso es porque ninguno de los gases reales se comporta como un gas ideal. La principal diferencia entre la constante de gas universal y la constante de gas característica es que la constante de gas universal es aplicable solo para gases ideales, mientras que la constante de gas característica es aplicable para gases reales.
Descargar la versión PDF de Universal Gas Constant vs Característica de gas constante
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según las notas de la cita. Descargue la versión PDF aquí Diferencia entre la constante de gas universal y la constante de gas característica.


