Diferencia entre la valencia y los electrones del núcleo
El diferencia clave Entre la valencia y los electrones del núcleo es que Los electrones de valencia participan en formaciones de enlace químico, mientras que los electrones de núcleo no.
Los átomos son los bloques de construcción de todas las sustancias existentes. Son tan pequeños que ni siquiera podemos observarlos a nuestro simple vista. En general, los átomos están en el rango de Angstrom. El átomo está formado por un núcleo, que tiene protones y neutrones. Hay electrones dando vueltas alrededor del núcleo en orbitales. La mayor parte del espacio en un átomo está vacío. Las fuerzas atractivas entre el núcleo cargado positivamente (carga positiva debido a protones) y los electrones cargados negativamente mantienen la forma del átomo. Los electrones residen en orbitales como pares en átomos, y tienen giros opuestos. Además, hay dos tipos de electrones como electrones de valencia y electrones de núcleo.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los electrones de valencia?
3. ¿Qué son los electrones del núcleo?
4. Comparación de lado a lado - Valencia vs electrones de núcleo en forma tabular
5. Resumen
¿Qué son los electrones de valencia??
Los electrones de valencia son los electrones en un átomo que participan en la formación de enlaces químicos. Cuando se forman productos químicos, un átomo puede obtener electrones, donar electrones o compartir electrones. La capacidad de donar, ganar o compartir estos electrones depende de la cantidad de electrones de valencia que tienen. Por ejemplo, cuando una H2 Se forma la molécula, un átomo de hidrógeno da un electrón al enlace covalente. Por lo tanto, dos átomos comparten dos electrones. Por lo tanto, un átomo de hidrógeno tiene un electrón de valencia. En la formación de cloruro de sodio, un átomo de sodio da un electrón, mientras que un átomo de cloro toma un electrón. Sucede para llenar un octeto en sus orbitales de valencia. Allí, el sodio tiene solo un electrón de valencia, y el cloro tiene siete. Por lo tanto, al observar los electrones de valencia, podemos determinar la reactividad química de los átomos.
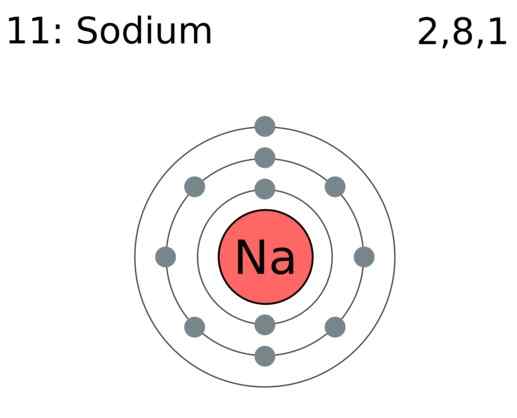
Figura 01: el átomo de sodio tiene un electrón de valencia
Los elementos grupales principales (Grupo I, II, III, etc.) tienen electrones de valencia en las cubiertas más externas. El número de electrones de valencia es equivalente a su número de grupo. Los átomos inertes han completado las cáscaras con el número máximo de electrones de valencia. Para los metales de transición, algunos electrones internos también actúan como electrones de valencia. El número de electrones de valencia se puede determinar mirando la configuración de electrones del átomo. Por ejemplo, el nitrógeno tiene la configuración de electrones de 1s2 2S2 2P3. Los electrones en los 2Dakota del Norte La carcasa (que es el número cuántico principal más alto en este caso) se toman como electrones de valencia. Por lo tanto, el nitrógeno tiene cinco electrones de valencia. Además de participar en la unión, los electrones de valencia son la razón de la conductividad térmica y eléctrica de los elementos.
¿Qué son los electrones del núcleo??
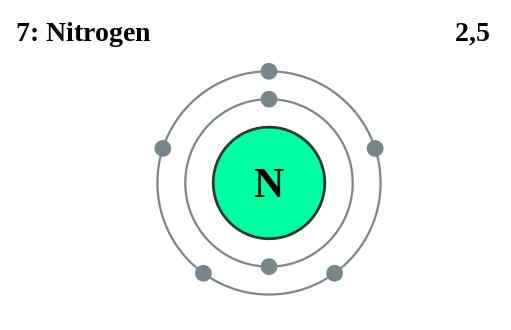
Los electrones del núcleo son electrones que no sean electrones de valencia del átomo. Dado que estos electrones residen en las ubicaciones internas del átomo, los electrones del núcleo no participan en la formación de enlaces. Residen en conchas internas de un átomo. Por ejemplo, en un átomo de nitrógeno (1s2 2S2 2P3), cinco electrones de los siete son electrones de valencia, mientras que dos electrones 1 son electrones de núcleo.

Figura 02: el nitrógeno tiene dos electrones de núcleo
Además, la energía requerida para eliminar un electrón de núcleo de un átomo es extremadamente mayor que la energía requerida para los electrones de valencia.
¿Cuál es la diferencia entre la valencia y los electrones del núcleo??
Tanto los electrones de valencia como los electrones del núcleo se mueven alrededor del núcleo de un átomo. Los electrones de valencia residen en las cubiertas de electrones más exteriores, mientras que los electrones del núcleo residen en las cubiertas internas. Por ejemplo, un átomo de nitrógeno tiene 5 electrones de valencia y 2 electrones de núcleo de acuerdo con la configuración de electrones; 1s2 2S2 2P3. Aboveall, la diferencia clave entre la valencia y los electrones del núcleo es que los electrones de valencia participan en la formación de enlaces químicos, pero los electrones del núcleo no.
Además, otra diferencia significativa entre la valencia y los electrones del núcleo es que la energía requerida para eliminar los electrones del núcleo es muy alta en comparación con la energía requerida para eliminar los electrones de valencia.
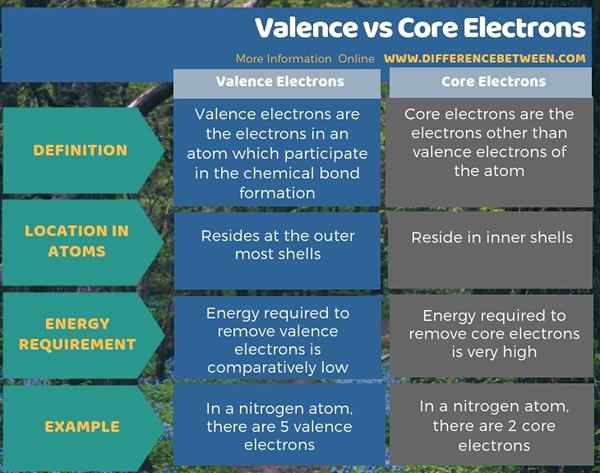
Resumen -Valencia vs electrones de núcleo
Hay dos tipos de electrones en un átomo como electrones de valencia y electrones de núcleo. Los electrones de valencia residen en las cubiertas más externas, mientras que los electrones del núcleo están en las carcasas internas. La diferencia clave entre la valencia y los electrones del núcleo es que los electrones de valencia participan en la formación de enlaces químicos, mientras que los electrones del núcleo no.
Referencia:
1. "1.3: Electrones de valencia y valencias abiertas."Bibliotecas de química, Librettexts, 23 APR. 2019, disponible aquí.
2. "1.9B: Valencia y electrones de núcleo."Bibliotecas de química, Librettexts, 2 de mayo de 2019, disponible aquí.
Imagen de cortesía:
1. "Electron Shell 011 Sodium" de Greg Robson - Aplicación: Inkscape (CC BY -SA 2.0 Reino Unido) Vía Commons Wikimedia
2. "Electron Shell 007 Nitrógeno" Par pumbaa (trabajo original de Greg Robson) - Archivo: Electron Shell 007 Nitrógeno.PNG, (CC BY-SA 2.0 Reino Unido) Vía Commons Wikimedia


