Diferencia entre la carcasa de valencia y la penúltima carcasa
El diferencia clave Entre Valence Shell y Penultimate Shell está que La cubierta de valencia es la cubierta que contiene electrones más externos de un átomo, mientras que la sábana penúltima es la cubierta que es interna a la cubierta que contiene electrones más externos.
Los términos shell de valencia y la penúltima caparazón se utilizan principalmente en química general al determinar la composición de los electrones de un átomo particular. Valence Shell y Penultimate Shell contienen uno o más electrones.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un caparazón de valencia?
3. ¿Qué es un sellado penúltimo?
4. Comparación de lado a lado - Valence Shell vs Penultimy Shell en forma tabular
5. Resumen
¿Qué es un caparazón de valencia??
Una cubierta de valencia es la cubierta que contiene electrones más externos de un átomo. Los electrones en esta cubierta se llaman electrones de valencia. Estos son los electrones que tienen la menor atracción hacia el núcleo de un átomo. Es porque los electrones de valencia se encuentran a una larga distancia del núcleo en comparación con los otros electrones de ese átomo.
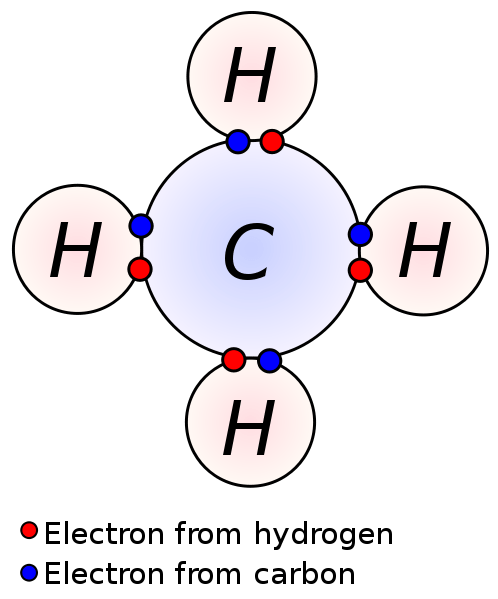
Figura 01: electrones de valencia involucrados en la formación de enlaces
Los electrones en la cubierta de valencia son responsables de las reacciones químicas y los enlaces químicos de los átomos. Dado que la atracción entre estos electrones y el núcleo de un átomo es menor, los electrones de valencia se pueden eliminar fácilmente (que los electrones en las orbitales internas). Esto es importante en la formación de compuestos iónicos y compuestos covalentes. Al perder electrones de valencia, los átomos pueden formar cationes. Compartir electrones de valencia de un átomo con los electrones de valencia de otro átomo dan como resultado enlaces covalentes.
Para elementos de bloque S y elementos de bloque P, las conchas de valencia son orbitales S y orbitales P, respectivamente. Pero para los elementos de transición, los electrones de valencia también pueden estar presentes en los orbitales internos. Esto se debe a la diferencia de energía entre los suborbitales. Por ejemplo, el número atómico de manganeso (MN) es 25. La configuración de electrones de Cobalt es [AR] 3D54s2. Los electrones de valencia del cobalto deben estar en el orbital 4S. Pero hay 7 electrones de valencia en MN. Los electrones en el orbital 3D también se consideran electrones de valencia porque el orbital 3D se encuentra fuera del orbital 4S (la energía de 3D es mayor que el orbital 4S).
¿Qué es el shell penúltimo??
La penúltima carcasa es la carcasa que contiene electrones que es interna para la carcasa de valencia más externa. En otras palabras, es la segunda concha llena de electrones o la carcasa antes de la carcasa de valencia. Por lo tanto, en comparación con la cubierta de valencia, la penúltima capa tiene electrones que se sienten más atraídos por el núcleo atómico.

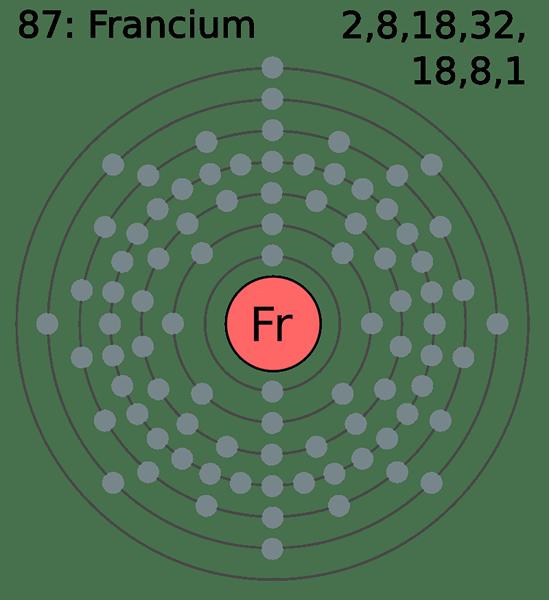
Figura 02: Attom Francium que tiene ocho electrones en la penúltima carcasa
Además, los electrones en la penúltima capa no participan en los procesos de unión química y formación de compuestos porque están cubiertos de los electrones de la carcasa de valencia. Sin embargo, en los metales de transición, los electrones en la penúltima carcasa pueden ser los electrones más externos del átomo de metal debido a la diferencia en las energías de los suborbitales.
¿Cuál es la diferencia entre la carcasa de valencia y el shell penúltimo??
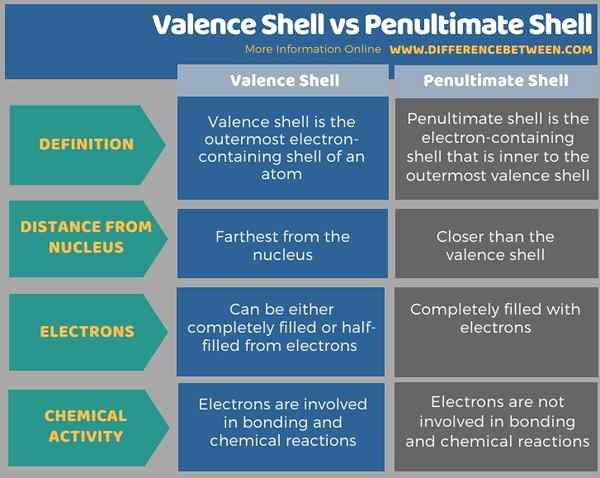
La diferencia clave entre la carcasa de valencia y la penúltima carcasa es que la cubierta de valencia es la cubierta que contiene electrones más externos de un átomo. Pero, la penúltima carcasa es la que interna a la carcasa más externa que contiene electrones. Por lo tanto, la penúltima capa está más cerca del núcleo atómico que la cubierta de valencia.
Además, los electrones en la cubierta de valencia se sienten menos atraídos por el núcleo atómico en comparación con los electrones en la penúltima carcasa. Además de eso, los electrones en la cubierta de valencia están involucrados en la unión química y la formación de compuestos, mientras que los electrones en la penúltima cubierta no están involucrados en reacciones químicas.
La infografía a continuación tabula las diferencias entre el caparazón de valencia y la penúltima carcasa.
Resumen -Valence Shell vs Penultimy Shell
Valence Shell y Penultimate Shell son dos términos químicos que son muy importantes en la química general. La diferencia clave entre la carcasa de valencia y la penúltima carcasa es que la carcasa de valencia es la cubierta que contiene electrones más externo de un átomo, mientras que la penúltima carcasa es la cubierta que es interna a la capa más externa que contiene electrones.
Referencia:
1. Helmenstine, Anne Marie. "Definición de electrones de valencia en química."Thinkco, febrero. 11, 2020, disponible aquí.
2. "Electrón de valencia."Wikipedia, Fundación Wikimedia, 6 de febrero. 2020, disponible aquí.
Imagen de cortesía:
1. "Covalent" de Dynablast: creado con Inkscape (CC BY -SA 2.5) Vía Commons Wikimedia
2. "Electron Shell 087 Francium" (CC BY-SA 2.0 Reino Unido) Vía Commons Wikimedia


