Diferencia entre valencia y número de oxidación
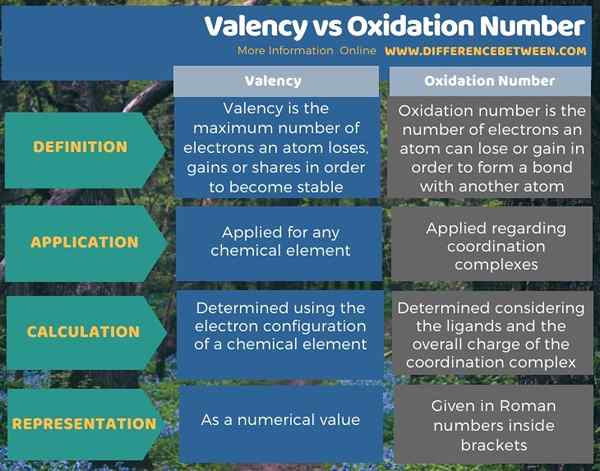
El diferencia clave entre valencia y número de oxidación es que La valencia es el número máximo de electrones que un átomo puede perder, ganar o compartir para ser estable, mientras que el número de oxidación es el número de electrones que un átomo puede perder o ganar para formar un enlace con otro átomo.
Los términos número de oxidación y valencia están relacionados con los electrones de valencia de un átomo. Los electrones de valencia son los electrones que ocupan los orbitales más externos de un átomo. Estos electrones tienen una atracción débil hacia el núcleo atómico; Por lo tanto, los átomos pueden eliminar o compartir fácilmente estos electrones con otros átomos. Esta pérdida, ganancia o intercambio de electrones hace que un átomo particular tenga un número de oxidación y valencia, y eventualmente forma un enlace químico entre los dos átomos.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es valencia
3. ¿Qué es el número de oxidación?
4. Comparación de lado a lado - Valencia vs número de oxidación en forma tabular
5. Resumen
Que es valencia?
La valencia es el número máximo de electrones que un átomo pierde, ganancias o acciones para ser estable. Para metales y no metales, la regla octeta describe la forma más estable de un átomo. Aquí, si el número de la cubierta más externa de un átomo se llena por completo (necesita ocho electrones para esta finalización), esa configuración de electrones es estable. En otras palabras, si los suborbitales S y P se llenan por completo con NS2notario público6 Configuración, el átomo es estable.
Naturalmente, los átomos de gas nobles tienen esta configuración de electrones. Por lo tanto, otros elementos deben perder, ganar o compartir electrones para obedecer la regla del octeto. El número máximo de electrones que un átomo necesita perder, ganar o compartir en esta estabilización es la valencia de ese átomo.
Por ejemplo, consideremos el silicio. La configuración electrónica de Silicon es 1S22S22P63S23P2. La cubierta más externa es n = 3, y tiene 4 electrones. Por lo tanto, debe obtener cuatro electrones más para completar el octeto. En general, el silicio puede compartir 4 electrones con otros elementos para completar el octeto. Por lo tanto, la valencia del silicio es 4.
Para diferentes elementos químicos, la valencia difiere. Es porque los electrones se llenan a los orbitales de acuerdo con los niveles de energía de esos orbitales. Sin embargo, la mayoría de los metales de transición tienen la misma valencia; a menudo son 2. Pero, algunos elementos pueden tener valencias de diferencia porque el átomo puede estabilizarse en diferentes configuraciones de electrones eliminando electrones.
Por ejemplo, en hierro (Fe), la configuración de electrones es [AR] 3D64s2. Por lo tanto, la valencia del hierro es 2 (2 electrones en 4s2). Pero a veces, la valencia del hierro se convierte en 3. Es porque el 3D5 La configuración de electrones es más estable que 3D6. Por lo tanto, eliminar un electrón más junto con los electrones 4S estabilizará el hierro más.
¿Qué es el número de oxidación??
El número de oxidación es el número de electrones que un átomo puede perder o ganar para formar un enlace con otro átomo. A veces, usamos los términos estado de oxidación y número de oxidación indistintamente, pero tienen ligeras diferencias.
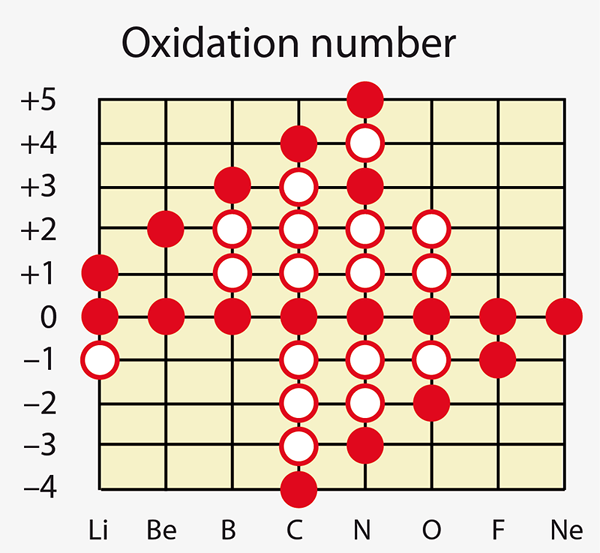
Figura 01: Algunos elementos químicos pueden mostrar diferentes números de oxidación
La mayoría de las veces, el término número de oxidación se aplica para complejos de coordinación. En los complejos de coordinación, el número de oxidación es la carga del átomo central de un compuesto de coordinación si todos los enlaces alrededor de ese átomo eran enlaces iónicos. Los complejos de coordinación casi siempre se componen de átomos de metal de transición en el centro del complejo. Este átomo de metal tiene grupos químicos en su entorno, que nombramos como ligandos. Estos ligandos tienen pares de electrones solitarios que se pueden compartir con átomos de metal para formar enlaces de coordinación.
Después de la formación del enlace de coordinación, es similar a un enlace covalente. Es porque los dos átomos en los enlaces de coordinación comparten un par de electrones, al igual que un enlace covalente. Sin embargo, tenemos que calcular el número de oxidación del átomo de metal central considerando los enlaces de coordinación como enlaces iónicos.
¿Cuál es la diferencia entre valencia y número de oxidación??
Los términos número de oxidación y valencia están relacionados con los electrones de valencia de un átomo. La diferencia clave entre la valencia y el número de oxidación es que la valencia es el número máximo de electrones que un átomo puede perder, ganar o compartir para ser estable, mientras que el número de oxidación es el número de electrones que un átomo puede perder o ganar para formar un enlace con otro átomo. Además, el término valencia se aplica para cualquier elemento químico, pero el término número de oxidación se aplica principalmente con respecto a los complejos de coordinación.
A continuación, la infografía resume la diferencia entre la valencia y el número de oxidación.

Resumen -Valencia vs número de oxidación
Tanto el número de oxidación como la valencia son términos relacionados con los electrones de valencia de un átomo. La diferencia clave entre la valencia y el número de oxidación es que la valencia es el número máximo de electrones que un átomo puede perder, ganar o compartir para ser estable, mientras que el número de oxidación es el número de electrones que un átomo puede perder o ganar para formar un enlace con otro átomo.
Referencia:
1. "Número de oxidación."Encyclopædia Britannica, Encyclopædia Britannica, Inc., Disponible aquí.
Imagen de cortesía:
1. "Números de oxidación del período 2" por ALBRIS - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia


