Diferencia entre los electrones de valencia y valencia
Diferencias clave - Valencia vs electrones de valencia
Los electrones de valencia y los electrones de valencia son términos interrelacionados y el diferencia clave Entre la valencia y los electrones de valencia se explica mejor en sus definiciones; electrones de valencia son los electrones en la cubierta más externa de un elemento mientras electrones de valencia son el número de electrones que deben aceptarse o eliminarse para alcanzar la configuración de gas noble más cercana. Son los electrones en la cubierta más externa los que generalmente contribuyen a formar enlaces químicos. En algunos átomos, el número de electrones de valencia es igual al número de electrones de valencia.
Que son velectrones alencios?
El número de electrones en la cubierta más externa de un átomo se llama "electrones de valencia". Por esta razón, la cubierta más externa de un átomo se llama "carcasa de valencia". La mayoría de las veces, estos son los electrones, que participan en la unión química. Cuando los elementos forman cationes, eliminan los electrones de la carcasa de valencia. El número de electrones de valencia en un elemento determina el grupo en la tabla periódica.
¿Qué son los electrones de valencia??
El número de electrones necesarios para ganar o perder para llenar la cubierta más externa de un átomo se llama "electrones de valencia". Para un átomo particular, el número de electrones de valencia depende del número de electrones de valencia en el átomo. Para el sodio, la valencia es igual a 1, porque elimina el último electrón en la cubierta más externa para lograr la estructura octeta del gas noble más cercano.
|
¿Cuál es la diferencia entre la valencia y los electrones de valencia??
Definición de valencia y electrones de valencia
Electrones de valencia: Los electrones en la cubierta más externa de un átomo se llaman "electrones de valencia". Para los elementos grupales "S" y "P", el número de electrones de valencia es igual a su número de grupo.
Ejemplo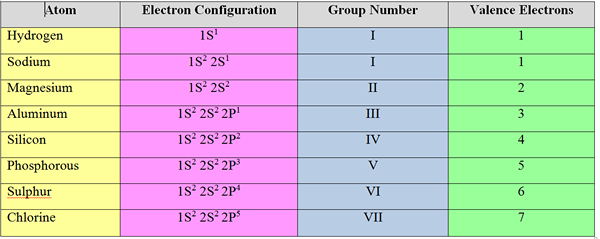
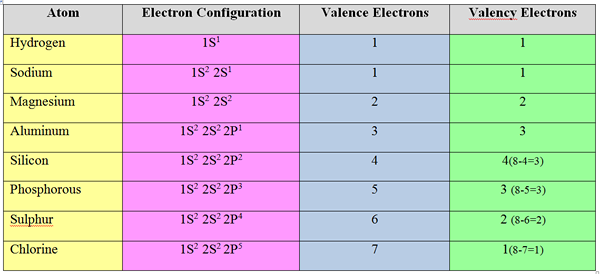
Electrones de valencia: El número de electrones que deben aceptarse o eliminarse para alcanzar la configuración de electrones del gas noble más cercano se llama "electrones de valencia" o la "valencia" de un átomo.
En general, para los elementos metálicos (elementos en el grupo I, II y III), el número de electrones de valencia es igual al número de electrones de valencia; eliminan los electrones en la cubierta de valencia para lograr la estructura del octeto.
Pero, los elementos no metálicos aceptan electrones para lograr la configuración de electrones del gas noble más cercano. Por lo tanto, la valencia de los elementos no metálicos se calcula restando los electrones de valencia total de 8.
Para el cloro, número de electrones de valencia = 8-7 = 1
Características de los electrones de valencia y valencia
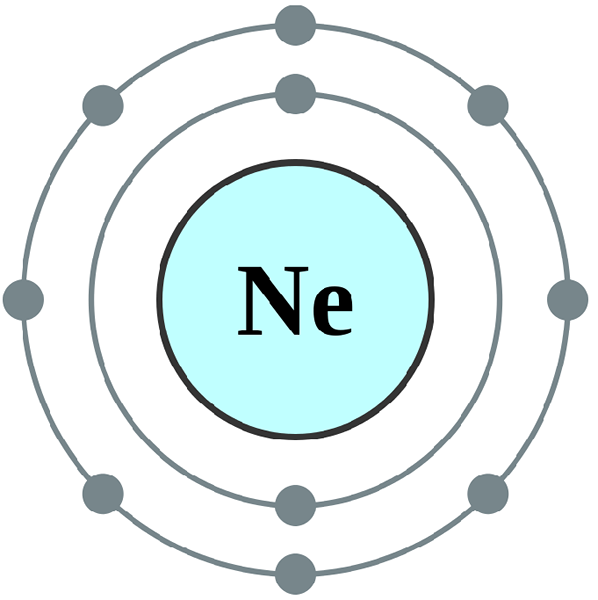
Electrones de valencia y valencia de los elementos del grupo VIII
Electrones de valencia: Los elementos del grupo VIII son los gases nobles, y son químicamente estables. Su carcasa externa está completa y contiene ocho electrones en la cubierta más externa (excepto helio -he); para que los electrones del Grupo VIII tienen ocho electrones de valencia.
Electrones de valencia: La valencia es una medida de la capacidad de formar enlaces con otros elementos o moléculas. Los gases nobles no aceptan ni eliminan electrones para lograr la regla del octeto, ya que ya han completado la última carcasa. Por lo tanto, la valencia de los elementos del Grupo VII igual a cero.
Imagen de cortesía:
"Electron Shell 010 Neon - No etiqueta" de Commons: Usuario: Pumbaa (Trabajo original de Commons: Usuario: Greg Robson) - http: // Commons.Wikimedia.org/wiki/categoría: electron_shell_diagrams (versión etiquetada correspondiente).(CC BY-SA 2.0 Reino Unido) Vía Commons

