Diferencia entre el análisis volumétrico y gravimétrico
El diferencia clave entre el análisis volumétrico y gravimétrico es que el El análisis volumétrico mide la cantidad de un analito usando volumen, mientras que el análisis gravimétrico mide la cantidad de un analito usando peso.
En un análisis, medimos la cantidad de un compuesto desconocido con el uso de una cantidad conocida de un compuesto conocido. Podemos tomar esta cantidad como un volumen o como peso. Si es volumen, lo llamamos "análisis volumétrico" o "análisis titrimétrico". Si es peso, lo llamamos "análisis gravimétrico". Ambas son técnicas analíticas cuantitativas porque estas técnicas pueden medir la cantidad de una muestra.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el análisis volumétrico?
3. ¿Qué es el análisis gravimétrico?
4. Comparación lado a lado: análisis volumétrico vs gravimétrico en forma tabular
5. Resumen
¿Qué es el análisis volumétrico??
El análisis volumétrico es un tipo de análisis cuantitativo en el que podemos medir la cantidad de un compuesto desconocido utilizando su volumen. Podemos usar titulaciones para este propósito. Por lo tanto, llamamos a este análisis un "análisis titrimétrico". En una titulación, utilizamos una segunda solución o reactivo para la determinación del volumen del compuesto desconocido presente en una muestra. Al determinar el volumen de lo desconocido, podemos determinar la concentración de ese compuesto en la muestra.
Análisis volumétrico para una titulación
Para una titulación, hay varios componentes que necesitamos en el sistema experimental. Esos componentes incluyen un Burette, Burette Holder, un vaso de precipitados o un frasco y pipetas de Erlenmeyer. Por lo general, llenamos el reactivo (con una concentración conocida) en la bureta y debemos llevar la muestra (que contiene el compuesto desconocido) en el vaso de precipitados (un volumen conocido). Además, debemos usar indicadores para la determinación del punto final de la titulación. Además, es importante elegir el indicador correcto para una titulación particular de acuerdo con el rango de pH en el que hacemos la titulación. Ej: El indicador de fenolftaleína funciona en el rango de pH de 8.3-10.0. El indicador da un cambio de color en el punto final. Ej: El color de la fenolftaleína a pH 8.3 es incoloro y a ph 10.0, muestra un color rosa pálido.

Figura 01: una titulación ácida-base
Además, el segundo reactivo que estamos llenando en la bureta debe tener una reacción considerable para dar un punto final (a menos que no dé un punto final o un cambio del color del indicador). Lo que medimos es el volumen del reactivo (en la burette) que reacciona con el compuesto en la muestra. Podemos usar relaciones estequiométricas para determinar los moles de lo desconocido presente en la muestra utilizando la siguiente ecuación.
C1V1 = C2V2
Aquí C1 es la concentración del reactivo en la bureta, V1 es el volumen del reactivo que reacciona con la muestra, C2 es la concentración desconocida de la muestra y V2 es el volumen de la muestra que tomamos en el vaso de precipitados para el análisis.
¿Qué es el análisis gravimétrico??
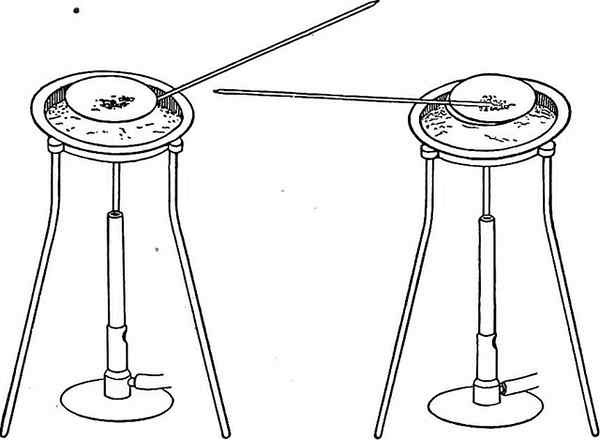
El análisis gravimétrico es un tipo de análisis cuantitativo en el que podemos determinar el peso de un compuesto desconocido en una muestra. Este método implica reacciones de precipitación para la separación del compuesto deseado de una muestra. Una reacción de precipitación puede convertir un compuesto disuelto en un precipitado que podemos sopesar. Si la muestra es una mezcla de varios sólidos, primero podemos disolver la muestra en un disolvente adecuado y luego podemos agregar un reactivo adecuado que pueda precipitar el compuesto que necesitamos. Lo llamamos agente precipitante. Eventualmente, podemos separar el precipitado a través de la filtración y pesar.
Lo más importante, el agente precipitante debe precipitar solo el compuesto requerido. Además, la filtración del debe lavar a todos los demás componentes que no sean el complejo requerido. Para la eliminación de componentes no deseados que aún se presentan en el precipitado, podemos lavar el precipitado usando agua o cualquier otro disolvente que no disuelva el precipitado. Entonces podemos secar el precipitado y pesar.

Figura 02: Evaporación de compuestos volátiles para aislar el precipitado
Además de la precipitación, podemos analizar un compuesto evaporando los componentes volátiles en la muestra a una temperatura apropiada. Podemos hacer esto calentando o descomponiendo químicamente la muestra. La volatilización puede ser directa o indirecta. El encendido es un ejemplo de un método directo. Un ejemplo de un método indirecto es la medición de la pérdida del contenido de agua de la muestra durante el tratamiento térmico.
¿Cuál es la diferencia entre el análisis volumétrico y gravimétrico??
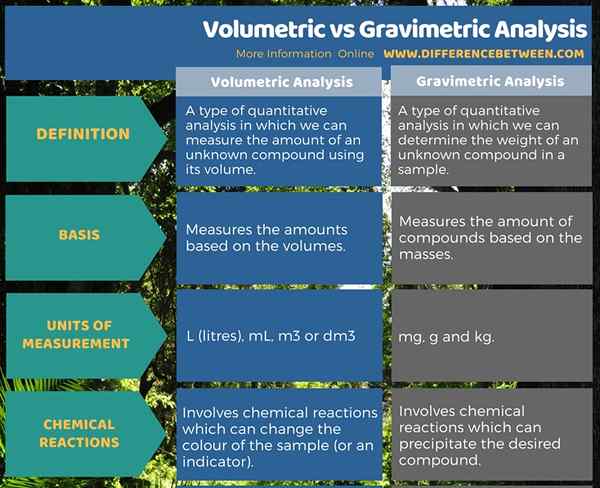
El análisis volumétrico es un tipo de análisis cuantitativo en el que podemos medir la cantidad de un compuesto desconocido utilizando su volumen. Mide el volumen del compuesto deseado en las unidades de volumen, como L (litros), ML, M3 o DM3. El análisis gravimétrico es un tipo de análisis cuantitativo en el que podemos determinar el peso de un compuesto desconocido en una muestra. Mide la masa del compuesto deseado en las unidades de mas como mg, g y kg. Esta es la principal diferencia entre el análisis volumétrico y gravimétrico.
Resumen -Análisis volumétrico vs gravimétrico
Podemos determinar la cantidad de un compuesto que está presente en una muestra dada utilizando análisis volumétrico o análisis gravimétrico. La diferencia entre el análisis volumétrico y gravimétrico es que el análisis volumétrico (o análisis titrimétrico) mide la cantidad de un analito usando volumen, mientras que el análisis gravimétrico mide la cantidad de un analito usando el peso.
Referencia:
1. Britannica, los editores de Encyclopedia. "Análisis volumétrico."Encyclopædia Britannica. Encyclopædia Britannica, Inc., 24 de junio de 2014. Disponible aquí
2. Britannica, los editores de Encyclopedia. "Análisis gravimétrico."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 17 de abril. 2018. Disponible aquí
Imagen de cortesía:
1.'Phenolphthalein en Flask'by 384 - Trabajo propio, (CC By -SA 4.0) a través de Commons Wikimedia
2.'14765613865' por Internet Archive Book Imágenes a través de Flickr


