Diferencia entre el trabajo y el calor
El diferencia clave entre el trabajo y el calor es que El trabajo es el movimiento ordenado en una dirección, mientras que el calor es el movimiento aleatorio de las moléculas.
El trabajo y el calor son los dos conceptos más importantes de termodinámica. El trabajo y el calor están altamente interrelacionados entre sí, pero no son del mismo. La búsqueda para comprender el trabajo y el calor se remonta. Con estos dos conceptos despejados, la termodinámica clásica se convirtió en uno de los campos "completos" en física. Tanto el calor como el trabajo son conceptos de energía. Las teorías del calor y el trabajo tienen un gran significado en la termodinámica, la mecánica del motor y la maquinaria.
CONTENIDO
1. Descripción general y diferencia de claves
2. Qué es trabajo
3. Que es el calor
4. Comparación de lado a lado: trabajo frente a calor en forma tabular
5. Resumen
Qué es trabajo?
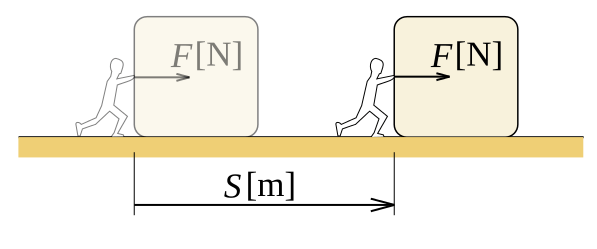
En física, definimos el trabajo como la cantidad de energía transferida por una fuerza que actúa a través de una distancia. El trabajo es una cantidad escalar, lo que significa que solo hay una magnitud para trabajar, una dirección no está presente. Considere un objeto que arrastramos sobre una superficie rugosa. Hay fricción actuando sobre el objeto. Para los puntos dados A y B, existen un número infinito de caminos entre ellos, por lo tanto, hay infinitas rutas para tomar la caja de A a B. Si la distancia del objeto viaja cuando lo tomamos en un camino determinado es, s, el trabajo realizado por la fricción en la caja es F.S, (considerando solo los valores escalar). Diferentes rutas tienen diferentes valores x. Por lo tanto, el trabajo realizado es diferente.
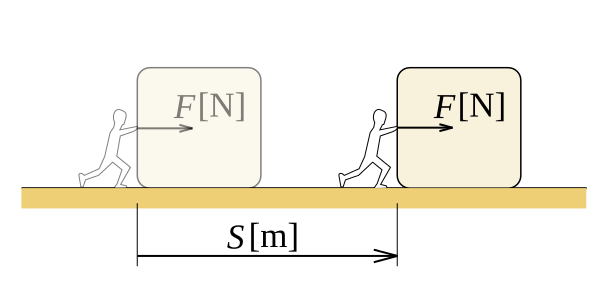
Figura 01: Trabajo realizado durante el movimiento de la distancia del objeto "S" con la fuerza "F"
Podemos demostrar que el trabajo depende de la ruta tomada, lo que significa que el trabajo es una función de la ruta. Para un campo de la fuerza conservadora, podemos tomar el trabajo realizado en función del estado. La unidad de trabajo SI es Joule, nombrada en honor del físico inglés James Joule. La unidad de trabajo CGS es ERG. En la termodinámica, cuando decimos trabajo, generalmente nos referimos al trabajo de presión, porque la presión interna o externa es el generador de fuerza que hace el trabajo. En una situación de presión constante, el trabajo realizado es P.ΔV, donde p es la presión y ΔV es el cambio de volumen.
Que es el calor?
El calor es una forma de energía. Podemos medirlo en Joule. La primera ley de la termodinámica es sobre la conservación de la energía. Establece que el calor suministrado a un sistema es igual al incremento de energía interna de ese sistema más el trabajo realizado por el sistema en los alrededores. Por lo tanto, esto muestra que podemos convertir el calor en trabajo, y viceversa.

Figura 02: el fuego produce energía térmica
Además, podemos definir el calor como la energía almacenada como movimiento aleatorio de moléculas o átomos. La cantidad de calor en un sistema solo depende del estado en el que se encuentre el sistema; Por lo tanto, el calor es una función del estado.
¿Cuál es la diferencia entre el trabajo y el calor??
El trabajo es la cantidad de energía transferida por una fuerza que actúa a través de una distancia, mientras que el calor es una forma de energía. La diferencia clave entre el trabajo y el calor es que el trabajo es el movimiento ordenado en una dirección, mientras que el calor es el movimiento aleatorio de las moléculas. Además, el trabajo es una función de la ruta, pero el calor es una función del estado.
Como otra diferencia importante entre el trabajo y el calor, podemos demostrar que el trabajo puede convertirse totalmente al calor, pero el calor no puede convertirse al 100% para trabajar. Además, el calor es una forma de energía, mientras que el trabajo es un método para transferir energía. La siguiente infografía sobre la diferencia entre el trabajo y el calor ofrece una comparación más detallada.
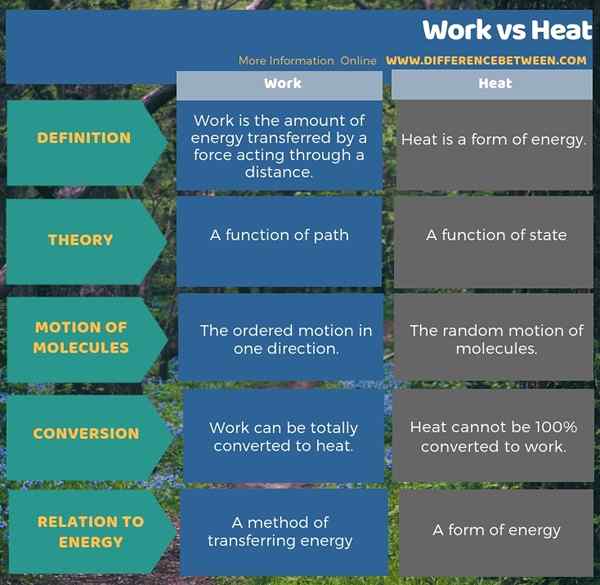
Resumen -Trabajo vs calor
El trabajo y el calor son conceptos que usamos tanto en física como en química. El trabajo y el calor están interrelacionados, sin embargo, hay algunas diferencias entre ellos también. La diferencia clave entre el trabajo y el calor es que el trabajo es el movimiento ordenado en una dirección, mientras que el calor es el movimiento aleatorio de las moléculas.
Referencia:
1. OpenStaxCollege. "Física universitaria."Introducción a la sociología - 1ª edición canadiense, Bccampus, 23 de enero. 2012. Disponible aquí
2. Jones, Andrew Zimmerman. "Una forma científica de definir la energía térmica."Thinkco, octubre. 11, 2018. Disponible aquí
Imagen de cortesía:
1."Trabajo (Física)" por すじにく シチュー シチュー シチュー シチュー - Trabajo propio, (CC0) a través de Commons Wikimedia
2."624524" (CC0) a través de pxhere