¿Cuál es la diferencia entre las enzimas alostéricas y no alostéricas?
El diferencia clave entre las enzimas alostéricas y no alostéricas es que las enzimas alostéricas tienen sitios alostéricos distintos de sus sitios activos para la unión de las moléculas reguladoras, mientras que las enzimas no alostéricas tienen solo un sitio activo para unirse con el sustrato.
Hay diferentes formas de regulación enzimática. La regulación alostérica es una de esas formas de regulación enzimática. La regulación alostérica es facilitada por enzimas llamadas enzimas alostéricas. Las moléculas reguladoras se unen a los sitios alostéricos poseídos por la enzima y regulan la actividad enzimática. Por lo tanto, las enzimas alostéricas también se conocen como enzimas reguladoras. La especialidad de las enzimas alostéricas es que poseen sitios adicionales distintos del sitio activo principal.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las enzimas alostéricas?
3. ¿Qué son las enzimas no alostéricas?
4. Similitudes - Enzimas alostéricas vs no alostéricas
5. Enzimas alostéricas vs no alostéricas en forma tabular
6. Resumen - Enzimas alostéricas versus no alostéricas
¿Qué son las enzimas alostéricas??
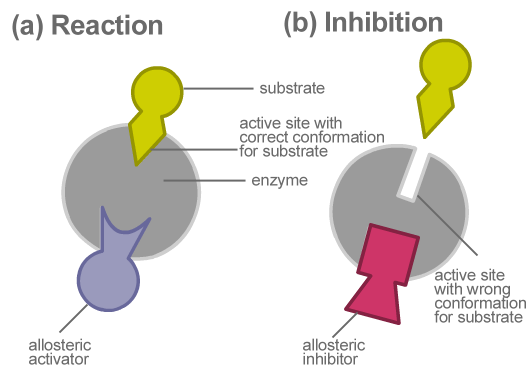
Las enzimas alostéricas son un tipo de enzima que posee sitios alostéricos para la unión de moléculas reguladoras. Estos sitios se encuentran en las diferentes subunidades de proteínas de la enzima. Una molécula reguladora puede ser un inhibidor o un activador. Cuando un inhibidor se une a la enzima, la actividad enzimática disminuye. Cuando un activador se une a la enzima, la función enzimática aumenta. Este tipo de regulación de la actividad enzimática se conoce como regulación alostérica. Una enzima alostérica es específica de su sustrato y sus moléculas reguladoras (moduladores). La interacción de la molécula/modulador regulador con la enzima es reversible y no covalente. Una reacción catalizada por una enzima alostérica muestra una curva sigmoidal.

Figura 01: inhibición alostérica
La regulación alostérica se lleva a cabo como mecanismo de retroalimentación. En la inhibición de la retroalimentación negativa, la molécula reguladora es un inhibidor e inhibe la reacción. En un mecanismo de retroalimentación positiva, una molécula o activador efector que se une al sitio alostérico aumenta la velocidad de reacción. La unión del modulador alostérico a una enzima alostérica cambia la conformación de la proteína, afectando así su función. Piruvato quinasa, ribonucleótido reductasa, aspartato transcarbamoilasa y ADP-glucosa pirofosforilasa son varios ejemplos de enzimas alostéricas.
¿Qué son las enzimas no alostéricas??
Las enzimas no alostéricas son las enzimas que no procesan sitios alostéricos que no sean el sitio activo. Por lo tanto, son enzimas simples que solo tienen un sitio activo de enzimas. Estas enzimas son enzimas específicas del sustrato. También son enzimas no reguladoras. Sus reacciones muestran una curva hiperbólica.
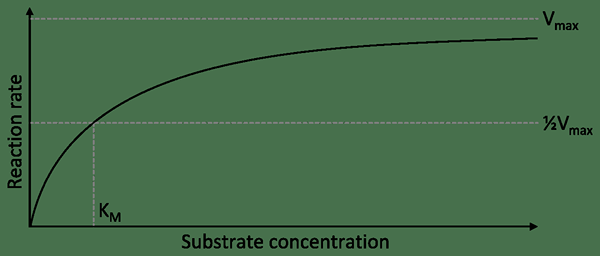
Figura 02: Curva hiperbólica que se muestra por una enzima no alosénica
Cuando hay un inhibidor competitivo, la velocidad de reacción disminuye. Un inhibidor competitivo es similar al sustrato. Por lo tanto, compite con el sustrato por vincular con el sitio activo. Cuando el sustrato no se une con el sitio activo, no se puede formar el complejo de la enzima del sustrato, por lo que la velocidad de reacción disminuye.
¿Cuáles son las similitudes entre las enzimas alostéricas y no alostéricas??
- Las enzimas alostéricas y no alostéricas son dos tipos de enzimas.
- Están compuestos de proteínas.
- Catalizan reacciones bioquímicas en las células vivas.
- Ambos tipos de enzimas permanecen sin cambios al final de la reacción.
- Una pequeña concentración de estas enzimas es suficiente para catalizar una reacción.
- Son sensibles a los cambios en el pH y la temperatura.
¿Cuál es la diferencia entre las enzimas alostéricas y no alostéricas??
Una enzima alostérica es una enzima que tiene un sitio adicional llamado sitio regulatorio o sitio alostérico para la unión de una molécula reguladora. Una enzima no alosterica es una enzima simple que solo tiene un sitio activo para la unión de su sustrato. Entonces, esta es la diferencia clave entre las enzimas alostéricas y no alostéricas.
La siguiente infografía enumera las diferencias entre las enzimas alostéricas y no alostéricas en forma tabular para la comparación de lado a lado.
Resumen -Enzimas alostéricas versus no alostéricas
La enzima alostérica es una enzima reguladora que posee un sitio alostérico que no sea el sitio activo. Por lo tanto, una molécula reguladora puede unirse con el sitio alostérico y regular la actividad enzimática. Por el contrario, la enzima no alostérica no tiene un sitio alostérico. Tiene solo un sitio activo. Las enzimas no alostásicas no son enzimas reguladoras. Las enzimas alostéricas son específicas de la molécula reguladora y reguladora, mientras que las enzimas no alostéricas son específicas del sustrato. Por lo tanto, este es el resumen de la diferencia entre las enzimas alostéricas y no alostéricas.
Referencia:
1. "Regulación enzimática (artículo)." Academia Khan.
2. "Enzimas."Lumen.
Imagen de cortesía:
1. "Inhibición alostérica" por [[: en: user: 1 | 1]] en la wikipedia en inglés (cc by-sa 3.0) a través de Commons Wikimedia
2. "Michaelis Menten Curve 2" de Thomas Shafee - Trabajo propio (CC por 4.0) a través de Commons Wikimedia


