¿Cuál es la diferencia entre la aspartil cisteína y las serina proteasas?
El diferencia clave entre la aspartil cisteína y las serina proteasas son sus grupos funcionales que actúan como residuos catalíticos. El grupo funcional que actúa como los residuos catalíticos de la aspartil proteasa es un grupo de ácido carboxílico, mientras que en la cisteína proteasa, un grupo de tiol o sulfhidrilo actúa como el grupo funcional en el residuo catalítico, y en serina proteasa, un grupo hidroxilo o un alcohol actúa el alcohol. Como grupo funcional en el residuo catalítico.
Las proteasas son enzimas que catalizan la proteólisis, que es la descomposición de proteínas en polipéptidos o aminoácidos más pequeños. Este proceso tiene lugar escindiendo enlaces peptídicos dentro de proteínas mediante un proceso de hidrólisis. Las proteasas están involucradas en muchas funciones biológicas, como la digestión de las proteínas ingeridas, el catabolismo de las proteínas y la señalización celular. Las proteasas están presentes en todas las formas de vida. El aspartilo, la cisteína y la serina son tres proteasas importantes que juegan un papel clave en los organismos vivos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las proteasas de aspartilo?
3. ¿Qué son las cisteína proteasas?
4. ¿Qué son las serinas proteasas?
5. Similitudes: aspartil cisteína y serina proteasas
6. Aspartilo vs cisteína vs proteasas de serina en forma tabular
7. Resumen -Pastaril vs Cisteína vs serina proteasas
¿Qué son las proteasas de aspartilo??
Las proteasas de aspartilo son un tipo de enzimas que rompen proteínas. Tienen dos aspartatos altamente conservados en el sitio activo, y son óptimamente activos a pH ácido. Estas proteasas escinden enlaces de dipéptidos que tienen residuos hidrofóbicos, así como un grupo de beta-metileno. El mecanismo catalítico de la aspartilo proteasa es un mecanismo ácido-base. Esto implica la coordinación de una molécula de agua con dos residuos de aspartato. Un aspartato activa la molécula de agua al eliminar un protón. Esto permite que el agua realice un ataque nucleofílico en el carbono carbonilo del sustrato. Como resultado, genera un intermedio de oxianión tetraédrico que se estabiliza mediante enlaces de hidrógeno con el segundo residuo de aspartato. El reordenamiento de este intermedio es responsable de la división del péptido en dos productos de péptidos.
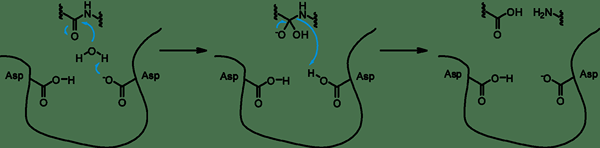
Figura 01: proteasa de aspartilo
Hay cinco superfamilias de proteasas aspárticas: clan aa que es una familia, clan ac, que es una familia de peptidasa II señala, clan AD, que es una familia presenilina, clan ae, que es una familia de endopeptidasa GPR, y clan AF, que es una familia Omptin.
¿Qué son las cisteína proteasas??
Las cisteína proteasas son un grupo de enzimas hidrolasas que degradan las proteínas. Muestran un mecanismo catalítico que involucra un cisteína nucleofílico tiol en una tríada catalítica o díada. El paso inicial en el mecanismo catalítico de las cisteína proteasas es la desprotonación. El grupo tiol se desprotona dentro del sitio activo de la enzima mediante un aminoácido adyacente como la histidina, que tiene una cadena lateral básica. El siguiente paso es el ataque nucleofílico por el azufre aniónico desprotonado de cisteína en el sustrato. Aquí, el fragmento del sustrato se libera con una amina, y el residuo de histidina en la proteasa restaura su forma desprotonada. Esto da como resultado la formación del intermedio tioester del sustrato, que une el nuevo terminal carboxi con el cisteine tiol. El enlace tioester se hidroliza para generar el resto ácido carboxílico en el fragmento de sustrato restante.
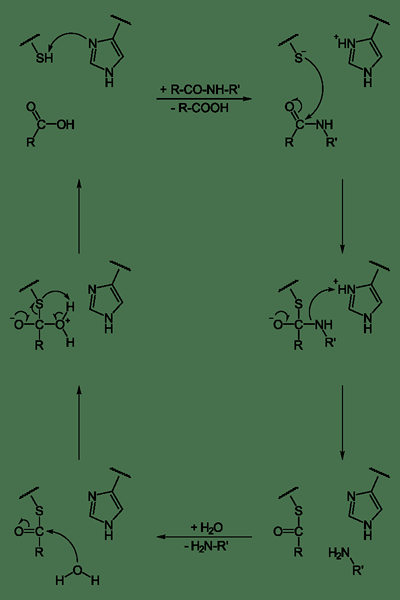
Figura 02: cisteína proteasa
Las proteasas de cisteína juegan múltiples roles en fisiología y desarrollo. En las plantas, juegan un papel importante en el crecimiento, desarrollo, acumulación y movilización de proteínas de almacenamiento. En humanos, son importantes en la senescencia y la apoptosis, las respuestas inmunes, el procesamiento de prohormonas y la remodelación de la matriz extracelular al desarrollo de cono.
¿Qué son las serinas proteasas??
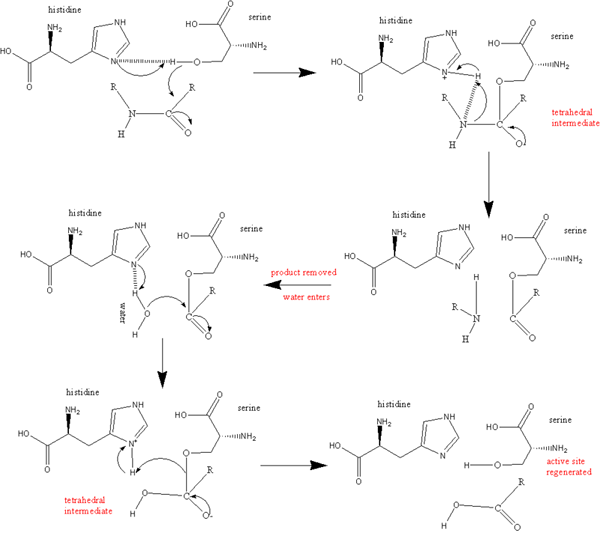
Las serinas proteasas también son un grupo de enzimas proteolíticas que escinden los enlaces de péptidos en proteínas. La serina sirve como aminoácido nucleofílico en el sitio activo de la enzima. Estos están presentes tanto en eucariotas como en procariotas. Las serinas proteasas generalmente se dividen en diferentes categorías por una estructura distintiva que consta de dos dominios de barril beta que convergen en el sitio catalítico activo y también se basa en su especificidad de sustrato. Son como tripsina, como quimotripsina, como trombina, como elastasa y como sutilisina.

Figura 03: serina proteasa
Las proteasas similares a la tripsina cortan los enlaces de los péptidos después de un aminoácido cargado positivamente como la lisina o la arginina. Son específicos de los residuos cargados negativamente, como el ácido aspártico o el ácido glutámico. Las proteasas similares a la quimotripsina son más hidrófobas. Su especificidad se encuentra con grandes residuos hidrofóbicos como tirosina, triptófano y fenilalanina. Las proteasas similares a la trombina incluyen trombina, que es un plasminógeno que activa el tejido y la plasmina. Estos ayudan en la coagulación de la sangre y la digestión y también en la fisiopatología en los trastornos neurodegenerativos. Las proteasas similares a la elastasa prefieren residuos como alanina, glicina y valina. Las proteasas similares a la subtilisina incluyen serina en procariotas. Comparte un mecanismo catalítico que utiliza una tríada catalítica para crear una serina nucleófila. La regulación de la actividad de la serina proteasa requiere una activación inicial de la proteasa y la secreción de inhibidores.
¿Cuáles son las similitudes entre la aspartil cisteína y las serina proteasas??
- Aspartyl, cisteína y serina proteasas catalizan la descomposición de las proteínas por escisión de enlaces péptidos.
- Los mecanismos son similares cuando los residuos activos del sitio atacan los enlaces péptidos que hacen que se rompa.
- Todos contienen nucleófilos.
- Todos son proteínas.
¿Cuál es la diferencia entre la aspartil cisteína y las serina proteasas??
La diferencia clave entre la aspartil cisteína y las serina proteasas depende de su grupo funcional, que actúa como los residuos catalíticos. En la aspartilo proteasa, un grupo de ácido carboxílico actúa como el grupo funcional, mientras que en la cisteína proteasa, un grupo de tiol o sulfhidrilo actúa como el grupo funcional, y en la proteasa serina, un grupo hidroxilo o un alcohol actúa como el grupo funcional.
Las proteasas de aspartilo tienen un sitio activo de aspartato, mientras que las cisteína proteasas tienen un sitio activo de cisteína. El residuo activo del sitio de serina proteasa es un grupo hidroxilo. Por lo tanto, esta es también otra diferencia entre la aspartil cisteína y las serina proteasas. A diferencia de la serina y las cisteína proteasas, las aspartil proteasas no forman un intermedio covalente durante el proceso de escisión. Por lo tanto, la proteólisis ocurre en un solo paso para las proteasas de aspartilo.
La siguiente infografía presenta las diferencias entre la aspartilo cisteína y las serina proteasas en forma tabular para la comparación de lado a lado.
Resumen -Aspartil cisteína vs serina proteasas
Las proteasas son enzimas que catalizan la descomposición de las proteínas en polipéptidos o aminoácidos más pequeños. La diferencia clave entre la aspartil cisteína y las serina proteasas es el grupo funcional que actúa como su residuo catalítico. Un grupo de ácido carboxílico actúa como el grupo funcional en la proteasa de aspartilo, mientras que un grupo de tiol o sulfhidrilo actúa como el grupo funcional en la proteasa de la cisteína. Un grupo hidroxilo o un alcohol actúa como el grupo funcional en serina proteasa.
Referencia:
1. "Mecanismos de proteasa."Scable, Nature News, Nature Publishing Group.
2. "Cisteína proteasa."Science Direct.
3. "Serina proteasa."Science Direct.
Imagen de cortesía:
1. "Mecanismo de proteasa de aspartilo" por el usuario de Wikipedia en inglés Roadnottaken (CC BY-SA 3.0) a través de Commons Wikimedia
2. "CysteinProtease ReaktionsMechanismus" por Neurotiker - Trabajo propio (dominio público) a través de Commons Wikimedia
3. "Mecanismo de serina proteasa por Snellios" de Snellios en la Wikipedia en inglés (CC By-SA 3.0) a través de Commons Wikimedia


