¿Cuál es la diferencia entre avidina y estreptavidina?
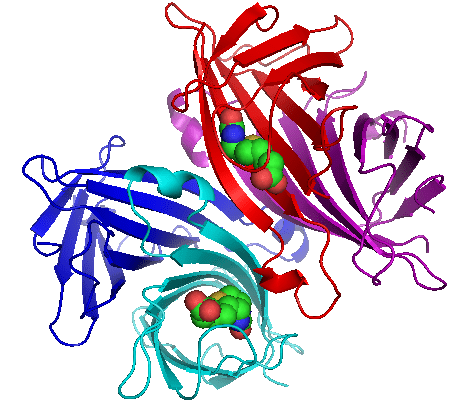
El diferencia clave entre avidina y estreptavidina es que la avidina tiene una alta afinidad y especificidad por la biotina, pero comparativamente menos afinidad que la estreptavidina porque la estreptavidina-biotina es uno de los complejos más fuertes que tiene un enlace no covalente.
La avidina es un tipo de proteína que se forma en los oviductos de las aves, los reptiles y los anfibios. La estreptavidina es un tipo de proteína que se prepara a partir de la purificación de la bacteria Streptomyces avidinii.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es Avidin?
3. ¿Qué es la estreptavidina?
4. Avidina vs estreptavidina en forma tabular
5. Resumen -Avidin vs Streptavidin
¿Qué es Avidin??
La avidina es un tipo de proteína que se forma en los oviductos de las aves, los reptiles y los anfibios. Esta proteína es una proteína de unión a biotina tetramérica que deposita en las blancos de los huevos. Hay miembros diméricos de avidin además de formas tetraméricas. Podemos encontrar estas formas diméricas en algunas bacterias. Al considerar la clara de huevo de gallina, tiene alrededor de 0.05% de avidina en relación con el contenido total de proteínas.

Figura 01: Estructura química y apariencia de la molécula de avidina
Hay cuatro subunidades idénticas en la proteína tetramérica. Por lo tanto, podemos llamarlo homotetrámero. Cada tetrámero puede unirse con biotina (también llamada vitamina B7). La afinidad y la especificidad de esta vinculación son muy altas. El complejo Avidin-Biotin es uno de los enlaces no covalentes más fuertes conocidos.
Podemos encontrar avidina funcional en huevos crudos. Cuando se cocina, la afinidad de biotina por Avidin se destruye. Sin embargo, la función natural del huevo de avidina aún no se sabe exactamente. Los científicos han postulado que esta proteína se forma en el oviducto del huevo como inhibidor del crecimiento bacteriano. Puede unirse con biotina (la biotina es útil para el crecimiento bacteriano).
Además, hay una forma no glucosilada de avidina disponible como producto comercial. Todavía se desconoce si esta forma no glucosilada ocurre de forma natural o no. Existen algunas aplicaciones importantes de esta proteína, incluidas aplicaciones de investigación, ensayos bioquímicos, medios de purificación, etc.
¿Qué es la estreptavidina??
La estreptavidina es un tipo de proteína que se prepara a partir de la purificación de la bacteria Streptomyces avidinii. Es un tetrámero. Hay homo-tetrámeros de estreptavidina que tienen una afinidad extraordinariamente alta por la biotina. Se sabe que la unión de la biotina a la estreptavidina es una de las interacciones más fuertes no covalentes en la naturaleza. Esta proteína es útil en biología molecular y bio-nanotecnología debido a la resistencia del complejo de estreptavidina-biotina hacia solventes orgánicos, desnaturalizantes, enzimas proteolíticas, temperaturas extremas, valores de pH y detergentes.
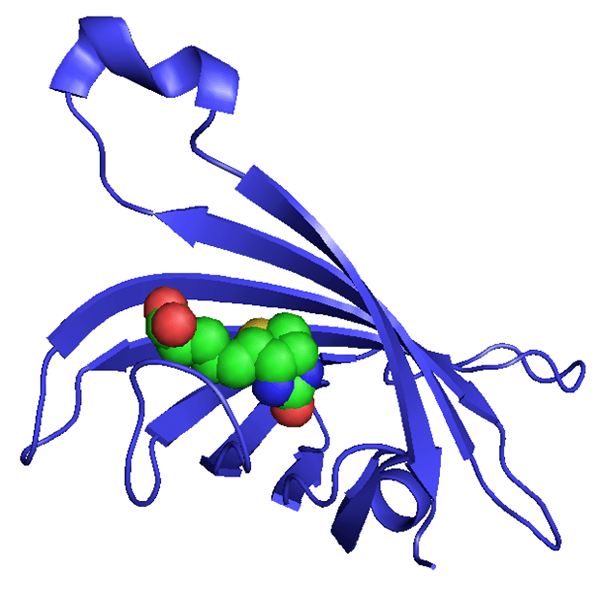
Figura 02: Estructura y apariencia de la molécula de estreptavidina
Existen importantes aplicaciones de estreptavidina, como la purificación o detección de varias biomoléculas, purificación y detección de péptidos genéticamente modificados, en transferencia Western, en desarrollo de nanobiotecnología, etc.
¿Cuál es la diferencia entre avidina y estreptavidina??
La avidina es un tipo de proteína que se forma en los oviductos de las aves, los reptiles y los anfibios. La estreptavidina es un tipo de proteína que se prepara a partir de la purificación de la bacteria Streptomyces avidinii. La diferencia clave entre la avidina y la estreptavidina es que la avidina tiene una alta afinidad y especificidad por la biotina, pero comparativamente menos afinidad que la estreptavidina porque la estreptavidina-biotina es uno de los complejos más fuertes que tiene un vínculo no covalente.
La siguiente infografía presenta las diferencias entre la avidina y la estreptavidina en forma tabular para la comparación de lado a lado.
Resumen -Avidin vs Streptavidin
La avidina y la estreptavidina son proteínas importantes. La diferencia clave entre la avidina y la estreptavidina es que la avidina tiene una alta afinidad y especificidad por la biotina, pero comparativamente menos afinidad que la estreptavidina porque la estreptavidina-biotina es uno de los complejos más fuertes que tiene un vínculo no covalente.
Referencia:
1. "Biotinilación." Thermo Fisher Scientific - EE. UU.
Imagen de cortesía:
1. "Tetramer" de Oxford Grad en English Wikipedia (CC By-SA 3.0) a través de Commons Wikimedia
2. "Streptavidin" de Roo1812 (imagen), Weber, P.C., Ohlendorf, D.H., Wendoloski, J.J., Salemme, F.Riñonal. (Datos utilizados) - Trabajo propio, utilizando PDB: 1STP (dominio público) a través de Commons Wikimedia


