¿Cuál es la diferencia entre Bohr y Schrodinger Model?
El Diferencia clave entre el modelo Bohr y Schrodinger es que en el modelo bohr, los electrones son partículas que ocupan solo ciertas órbitas de energía fija alrededor del núcleo, mientras que, en el modelo Schrodinger, los electrones se comportan como ondas estacionarias que tienen una mayor probabilidad de estar en algunas áreas de espacio en comparación con otras.
El modelo Bohr y el modelo Schrodinger son modelos muy importantes en química, ya que describen la estructura química de los átomos y la ubicación de los electrones en un momento dado.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el modelo bohr?
3. ¿Qué es el modelo Schrodinger?
4. Bohr vs Schrodinger Modelo en forma tabular
5. Resumen -Bohr vs Schrodinger Modelo
¿Qué es el modelo bohr??
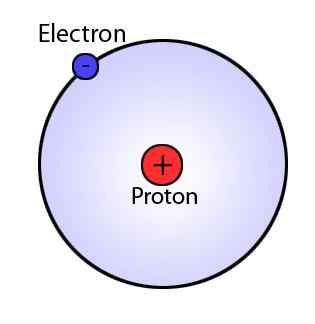
El modelo Bohr, que es una modificación del modelo Rutherford, explica la estructura del átomo como compuesta por un núcleo rodeado de electrones. Sin embargo, el modelo BOHR es muy avanzado que el modelo Rutherford, ya que sugiere que los electrones siempre viajan en capas o órbitas específicas alrededor del núcleo. Este modelo también afirma que estas conchas tienen diferentes energías y son de forma esférica. Este fenómeno fue sugerido por observaciones de los espectros de línea para el átomo de hidrógeno.
Dado que hay líneas discretas en los espectros de línea, Bohr declaró que los orbitales de un átomo tienen energías fijas, y los electrones pueden saltar de un nivel de energía a otro emisor o absorción de energía, lo que resulta en una línea en el espectro de la línea.

Figura 01: Modelo Bohr
Postulados principales del modelo BOHR
- Los electrones se mueven alrededor del núcleo en orbitales esféricos, que tienen un tamaño y energía fijos.
- Cada órbita tiene un radio diferente y se nombra desde el núcleo hacia el exterior como n = 1, 2, 3, etc., o n = k, l, m, etc., donde n es el número de nivel de energía fijo.
- La energía de un orbital está relacionada con su tamaño.
- La órbita más pequeña tiene la energía más baja. El átomo es completamente estable cuando los electrones están en el nivel de energía más bajo.
- Cuando un electrón se mueve en cierto orbital, la energía de ese electrón es constante.
- Los electrones pueden moverse de un nivel de energía a otro absorbiendo o liberando energía.
- Este movimiento causa radiación.
En general, el modelo de Bohr se ajusta perfectamente al átomo de hidrógeno, que tiene un solo electrón y un pequeño núcleo cargado positivamente. Además de eso, Bohr usó la constante de Plank para calcular la energía de los niveles de energía del átomo.
Pero hubo algunos inconvenientes del modelo BOHR al explicar la estructura atómica de los átomos que no sean hidrógeno.
Limitaciones del modelo BOHR
- El modelo Bohr no pudo explicar el efecto Zeeman (efecto del campo magnético en el espectro atómico).
- No pudo explicar el efecto marcado (efecto del campo eléctrico en el espectro atómico).
- El modelo Bohr no explica los espectros atómicos de átomos más grandes.
¿Qué es el modelo Schrodinger??
El modelo Schrodinger es un modelo en química que supone que un electrón es una ola. Este modelo describe regiones en el espacio o orbitales como ubicaciones donde los electrones tienen más probabilidades de ocurrir. Este es un modelo poderoso del átomo que fue desarrollado por Erwin Schrodinger en 1926. Combinó las ecuaciones para el comportamiento de las ondas y la ecuación de Broglie para crear un modelo matemático para describir la distribución de electrones en un átomo.

Figura 02: Función de onda según lo descrito por Schrodinger
La principal ventaja del modelo Schrodinger es que contiene ecuaciones matemáticas conocidas como funciones de onda, lo que puede satisfacer la necesidad de lugares en el comportamiento de los electrones. Sin embargo, puede ser difícil imaginar un modelo físico para los electrones como olas. En lugar de tratar de saber dónde está el electrón en cualquier momento, este modelo describe la probabilidad de que se encuentre un electrón en una región dada del espacio en un momento determinado.
¿Cuál es la diferencia entre Bohr y Schrodinger Model??
El modelo Bohr y el modelo Schrodinger son como los conceptos básicos de la química general. La diferencia clave entre el modelo bohr y schrodinger es que en el modelo bohr, los electrones son partículas que ocupan solo ciertas órbitas de energía fija alrededor del núcleo, mientras que, en el modelo Schrodinger, los electrones se comportan como ondas permanentes que tienen una mayor probabilidad de estar en algunos áreas de espacio en comparación con otras.
A continuación se muestra un resumen de la diferencia entre el modelo Bohr y Schrodinger en forma tabular para la comparación de lado a lado.
Resumen -Bohr vs Schrodinger Modelo
Tanto el modelo BOHR como el modelo Schrodinger describen la estructura química de los átomos y la ubicación de los electrones en un momento dado. La diferencia clave entre el modelo bohr y schrodinger es que en el modelo bohr, los electrones son partículas que ocupan solo ciertas órbitas de energía fija alrededor del núcleo, mientras que, en el modelo Schrodinger, los electrones se comportan como ondas permanentes que tienen una mayor probabilidad de estar en algunos áreas de espacio en comparación con otras.
Referencia:
1. "Modelo de Schrodinger." Erwin Schrodinger, Educación de Purdue.
Imagen de cortesía:
1. "Modelo Bohr" de JIA.Liu - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "WavePacket-A2K4-EN" por XCODEXIF-Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia


