¿Cuál es la diferencia entre catalizador e intermedia?
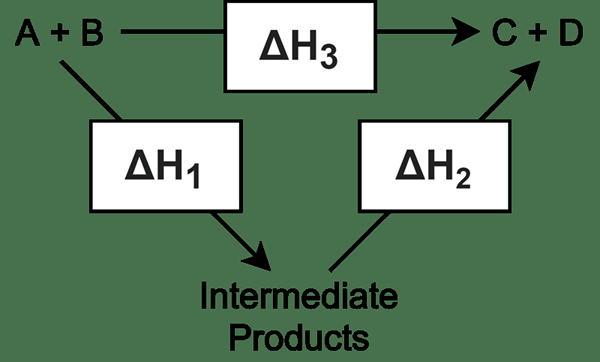
El diferencia clave entre catalizador e intermedia es que un catalizador es útil al comienzo de la reacción y se regenera al final, mientras que un intermedio se forma durante la reacción química y no existe al final de la reacción.
Los términos catalizador e intermedios son muy importantes en las reacciones químicas. Un catalizador es un compuesto químico que puede aumentar la velocidad de una reacción sin consumirse, mientras que un intermedio es una molécula que se forma de dos o más reactivos y sufre una reacción adicional para dar productos finales.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un catalizador?
3. ¿Qué es un intermedio?
4. Catalyst vs intermedia en forma tabular
5. Resumen -Catalyst vs Intermediate
¿Qué es un catalizador??
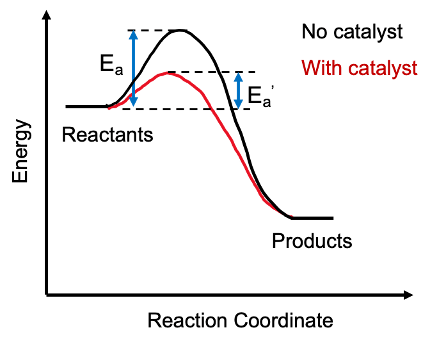
Un catalizador es un compuesto químico que puede aumentar la velocidad de una reacción sin ser consumido. Por lo tanto, este compuesto puede continuar actuando repetidamente. Debido a esta razón, solo se requiere una pequeña cantidad de catalizador para una determinada reacción química.
Un catalizador proporciona una vía alternativa para una reacción química al reducir la energía de activación de una reacción. Aquí, el catalizador se combina con el reactivo para crear un producto intermedio, y después de la finalización de la reacción requerida, el catalizador deja el intermedio y se regenera.
Hay dos tipos de catalizadores; Son catalizadores homogéneos y heterogéneos. En los catalizadores homogéneos, las moléculas están en la misma fase que las moléculas reactivas. Sin embargo, en los catalizadores heterogéneos, las moléculas están en una fase diferente a la de las moléculas reactivas. Las enzimas son un buen ejemplo de catalizadores biológicos.
¿Qué es un intermedio??
Un intermedio es una molécula que se forma de dos o más reactivos y sufre reacciones adicionales para dar productos finales. Se forma un intermedio en reacciones de múltiples pasos. La mayoría de las veces, las reacciones químicas complicadas requieren más de un paso para completar la reacción para obtener el producto final deseado. En estas reacciones, todos los pasos de reacción distintos del último paso dan intermedios; El último paso le da al producto en lugar de dar un intermedio. Por lo tanto, un intermedio es inestable y tiende a sufrir rápidamente una reacción adicional.

Por lo general, los intermedios ocurren en la mezcla de reacción muy raramente debido a su naturaleza inestable. Existen por un corto tiempo. Además, es muy difícil aislar un intermedio porque tiende a reaccionar más. En una reacción particular, puede haber un número muy alto de moléculas intermedias en cada paso de reacción. A veces, es muy difícil identificar estas moléculas.
Podemos distinguir entre intermedios y vibraciones moleculares. Estos generalmente tienen vidas similares y son simplemente transiciones. Por lo general, estas moléculas son altamente reactivas. Un buen ejemplo sería la esterificación de un diol, donde se produce un monoéster en el primer paso, y se forma un Dioester en el segundo (final).
¿Cuál es la diferencia entre catalizador e intermedia??
La diferencia clave entre el catalizador y el intermedio es que un catalizador es útil al comienzo de la reacción y se regenera al final, mientras que un intermedio se forma durante la reacción química y no existe al final de la reacción. Además, los catalizadores son estables, mientras que los intermedios son altamente inestables.
La siguiente infografía presenta las diferencias entre el catalizador y la intermedia en forma tabular para la comparación de lado a lado.
Resumen -Catalyst vs Intermediate
La diferencia clave entre el catalizador y el intermedio es que se agrega un catalizador al comienzo de la reacción y se regenera al final de la reacción, mientras que un intermedio se forma durante la reacción y no se regenera al final de la reacción.
Referencia:
1. Helmenstine, Anne Marie, PH.D. "¿Qué es una reacción intermedia??"Thinkco, agosto. 27, 2020.
Imagen de cortesía:
1. "Diagrama de energía de Catalyst" de Emma Ambrogi - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia
2. "Hess Cycle Diagram" de SGDWN - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia


