¿Cuál es la diferencia entre la constante crítica y la constante de van der waals?
El Diferencia clave entre constante crítico y constante Van der Waals Es que la constante crítica se refiere a los valores de temperatura, presión y densidad para una sustancia en el punto crítico, mientras que las constantes de van der Waals dan los valores de temperatura, presión y densidad para una sustancia en cualquier punto.
La única diferencia entre los valores constantes de la constante crítica y van der Waals es el punto en el que se calculan los valores. Por lo tanto, podemos derivar valores constantes críticos utilizando valores constantes de Van der Waals mediante el uso de los valores de punto crítico en la ecuación de Van der Waals.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es crítica constante?
3. ¿Qué es Van der Waals Constant?
4. Constante crítica vs van der waals constante en forma tabular
5. Resumen -Constante crítica vs van der Waals constante
¿Qué es crítica constante??
Constante crítica es la temperatura crítica, la presión crítica o la densidad crítica de cualquier sustancia. Este término generalmente se toma como un sustantivo plural porque puede referirse a tres condiciones (temperatura, presión o densidad) en el mismo punto. Podemos abreviar la temperatura crítica como TC, presión crítica como PC y densidad crítica como VC. Además, podemos calcular constantes críticas utilizando los valores de las constantes Van der Waals.

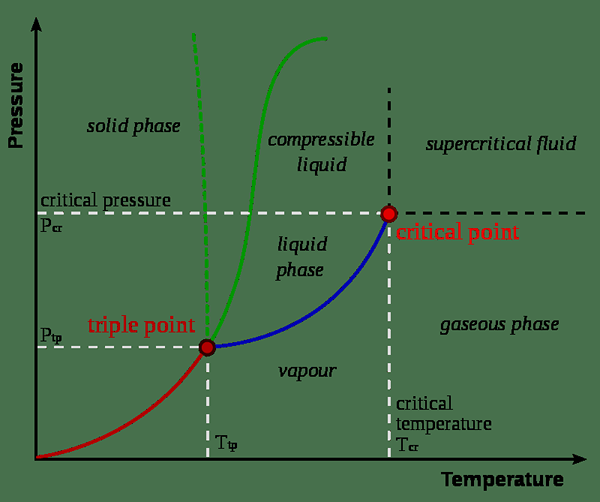
Figura 01: diagrama de fase
Por lo general, se dan valores constantes críticos para el punto crítico de una sustancia. El punto crítico de una sustancia es el punto final de la curva de equilibrio de fase de esa sustancia. Una curva de equilibrio de fase o un diagrama de fase es la gráfica de presión versus la temperatura en la que se muestran los cambios de fase de la sustancia. Esto muestra las temperaturas y la presión a la que la sustancia existe como un sólido, líquido o gas. El punto crítico es la temperatura y la presión a la que coexisten las fases de líquido y vapor.
¿Qué es Van der Waals Constant??
Las constantes de van der Waals son los valores constantes que usamos en la ecuación de van der Waals. La ecuación de van der Waal es la versión modificada de la ley de gas ideal. Esta ecuación se puede usar para gases ideales, así como para gases reales. La ley de gas ideal no se puede usar para gases reales porque el volumen de moléculas de gas es considerable en comparación con el volumen del gas real, y hay fuerzas de atracción entre las moléculas de gas reales (las moléculas de gas ideales tienen un volumen insignificante en comparación con el volumen total , y no hay fuerzas de atracción entre las moléculas de gas).
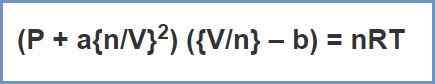
Figura 02: ecuación de van der Waals
Aquí, "A" es una constante que depende del tipo de gas y "B" también es una constante que da el volumen por mol de gas (ocupado por las moléculas de gas). Estos se utilizan como correcciones de la ecuación de ley ideal.
El volumen de una molécula de gas real no es insignificante (a diferencia de los gases ideales). Por lo tanto, la corrección de volumen se realiza. (V-B) es la corrección de volumen. Esto proporciona el volumen real que está disponible para que la molécula de gas se mueva (volumen real = volumen total - volumen efectivo).
La presión de un gas es la presión ejercida por una molécula de gas en la pared del recipiente. Dado que hay fuerzas de atracción entre las moléculas de gas reales, la presión es diferente de la del comportamiento ideal. Entonces se debe hacer una corrección de presión. (P + a n/v 2) es la corrección de presión. (Presión ideal = presión observada + corrección de presión).
¿Cuál es la diferencia entre la constante crítica y la constante de van der waals??
Constante crítica y constante de van der waal son términos que son ligeramente diferentes entre sí. La diferencia clave entre la constante crítica y la constante de van der Waals es que la constante crítica se refiere a los valores de temperatura, presión y densidad para una sustancia en el punto crítico, mientras que las constantes de van der Waals dan los valores de temperatura, presión y densidad para una sustancia en cualquier momento.
La siguiente tabla resume la diferencia entre la constante crítica y la constante de van der Waals.
Resumen -Constante crítica vs van der Waals constante
Constante crítica y constante de van der waal son términos que son ligeramente diferentes entre sí. La diferencia clave entre la constante crítica y la constante de van der Waals es que el término constante crítica se refiere a los valores de temperatura, presión y densidad para una sustancia en el punto crítico, mientras que las constantes de van der Waals dan los valores de temperatura, presión y densidad para una sustancia en cualquier momento.
Referencia:
1. Baratuci, William. "Determinar las constantes de Van der Waal." CH2, Lección F, página 6 - Determinación de las constantes de Van der Waal.
Imagen de cortesía:
1. "Phase-DiaG2" de Matthieumarechal (CC BY-SA 3.0) a través de Commons Wikimedia


