¿Cuál es la diferencia entre las interacciones dipolo dipolo y el enlace de hidrógeno?
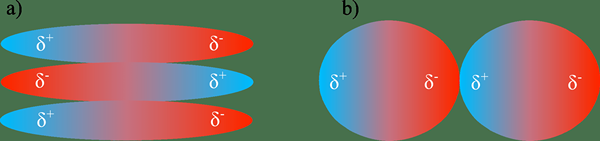
El Diferencia clave entre las interacciones dipolo dipolo y la unión de hidrógeno es que las interacciones dipolo dipolo ocurren cuando las moléculas cargadas parcialmente de forma negativa interactúan con una molécula vecina con una carga positiva, mientras que la unión de hidrógeno es un tipo especial de enlace dipolo dipolo fuerte que ocurre entre los átomos O, N y F y H.
Las interacciones dipolo-dipolo y los enlaces de hidrógeno son fenómenos muy importantes al estudiar la unión molecular, los comportamientos moleculares, las estructuras de cristal y muchos otros hechos químicos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las interacciones dipolo dipolo?
3. ¿Qué es el enlace de hidrógeno?
4. Interacciones dipolo dipolo frente al enlace de hidrógeno en forma tabular
5. Resumen: interacciones dipolo dipolo frente a enlaces de hidrógeno
¿Qué son las interacciones dipolo dipolo??
Las interacciones dipolo-dipolo o las fuerzas dipolo-dipolo son fuerzas intermoleculares que ocurren entre las moléculas polares. Estas son fuerzas electrostáticas. Al formar este tipo de fuerza, las moléculas polares tienden a alinearse para que la atracción entre las moléculas se maximice reduciendo la energía potencial. Esta alineación también reduce las repulsiones entre las moléculas.

Al considerar una serie de compuestos con masas molares similares (que tienen fuerzas de interacción dipolo-dipolo entre las moléculas), la resistencia de las fuerzas dipolo-dipolo aumenta a medida que aumenta la polaridad. Eso sucede porque la separación de carga es alta cuando la polaridad es alta. Cuando la molécula tiene una alta separación de carga (terminales positivas y negativas altamente cargadas en la misma molécula), tiende a atraer cargas opuestas. Esto también conduce a un aumento en el punto de ebullición de los compuestos. Mayores las fuerzas dipolo-dipolo, mayor es el punto de ebullición.
¿Qué es el enlace de hidrógeno??
Un enlace de hidrógeno puede describirse como un tipo de fuerza de atracción entre dos átomos de dos moléculas diferentes. Es una fuerza de atracción débil. Sin embargo, en comparación con otros tipos de fuerzas intramoleculares, como las interacciones polar-polares e interacciones no polar-nopolar como las fuerzas de Vander Waal, el enlace de hidrógeno es mucho más fuerte.
Típicamente, los enlaces de hidrógeno se forman entre las moléculas covalentes polares. Estas moléculas contienen enlaces covalentes polar, que se forman como resultado de la diferencia en los valores de electronegatividad de los átomos que están en el enlace covalente. Si esta diferencia es alta, el átomo altamente electronegativo tiende a atraer los electrones de unión hacia sí mismo. Por lo tanto, esto crea un momento dipolo en el que este átomo altamente electronegativo obtiene una carga negativa parcial, mientras que el otro átomo obtiene una carga positiva parcial. Entonces el enlace se convierte en un enlace covalente polar. Cuando esta molécula se encuentra con otra molécula que tiene un momento dipolar como este, las cargas negativas y positivas tienden a atraerse entre sí. Esta fuerza de atracción se llama unión de hidrógeno.
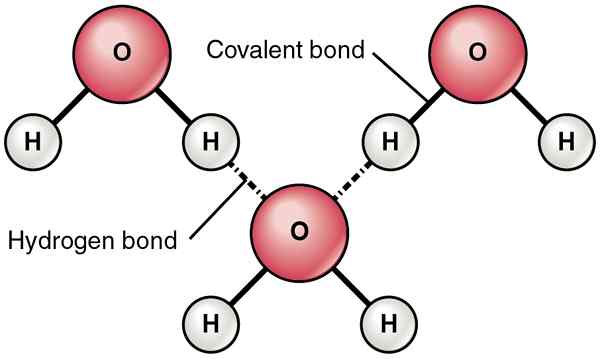
Además, los enlaces de hidrógeno se forman entre átomos altamente electronegativos y átomos menos electronegativos. Además, existen cuando tenemos O, N y F en una molécula y positivo H en la otra molécula. Esto se debe a que F, N y O son los átomos más electronegativos que son capaces de formar enlaces de hidrógeno.
¿Cuál es la diferencia entre las interacciones dipolo dipolo y el enlace de hidrógeno??
La diferencia clave entre las interacciones dipolo dipolo y la unión de hidrógeno es que las interacciones dipolo dipolo se producen cuando las moléculas cargadas parcialmente de forma negativa interactúan con una molécula vecina con una carga positiva, mientras que la unión de hidrógeno es un tipo especial de unión dipolo dipolo fuerte que ocurre entre O, N , F y h átomos.
La siguiente infografía presenta las diferencias entre las interacciones dipolo dipolo y el enlace de hidrógeno en forma tabular para la comparación de lado a lado.
Resumen: interacciones dipolo dipolo frente a enlaces de hidrógeno
Las interacciones dipolo-dipolo son fuerzas intermoleculares que ocurren entre las moléculas polares, mientras que el enlace de hidrógeno es un tipo de fuerza de atracción entre dos átomos de dos moléculas diferentes. The key difference between dipole dipole interactions and hydrogen bonding is that dipole dipole interactions occur when partially negatively charged molecules interact with a neighboring molecule with a positive charge, whereas hydrogen bonding is a special type of strong dipole dipole bonding that occurs between O, N, y átomos de F y H.
Referencia:
1. "Enlaces de hidrógeno." Bibliotecas de química, Libretexts, 11 de septiembre. 2022.
Imagen de cortesía:
1. "Interacciones dipolo" de Adam Rędzikowski - Archivo: Dipole_interacciones.PNG (CC BY-SA 3.0) a través de Commons Wikimedia
2. "210 enlaces de hidrógeno entre las moléculas de agua -01" por OpenStax College - Anatomía y fisiología, Sitio web de Connexions. 19 de junio de 2013. (CC por 3.0) a través de Commons Wikimedia


