¿Cuál es la diferencia entre electrolito y electrólisis?
El Diferencia clave entre electrolito y electrólisis es que el electrolito es una sustancia que puede producir iones, mientras que la electrólisis es un proceso en el que se utiliza una corriente eléctrica para impulsar una reacción química.
Utilizamos principalmente los términos electrolitos y electrólisis en electroquímica, donde investigamos la relación entre electricidad y química.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un electrolito?
3. ¿Qué es una electrólisis?
4. Electrolito vs electrólisis en forma tabular
5. Resumen - Electrolito versus electrólisis
¿Qué es un electrolito??
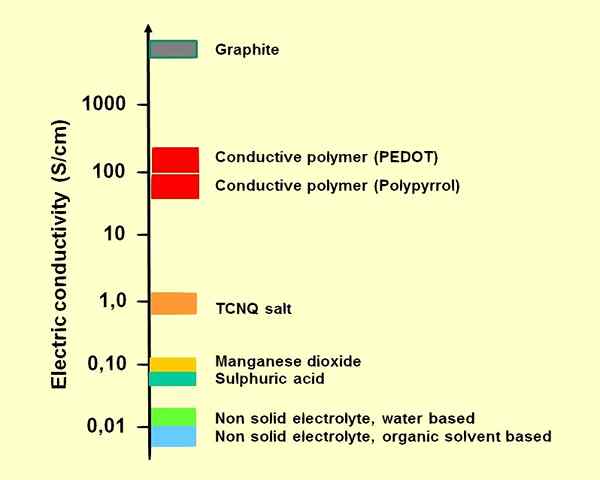
Un electrolito es una sustancia que puede producir iones. Los electrolitos proporcionan iones cuando están en la etapa fundida o cuando se disuelven en un disolvente (agua). Estos iones hacen que los electrolitos puedan realizar electricidad. Sin embargo, también hay algunos electrolitos de estado sólido. Además, algunos gases como el dióxido de carbono producen iones (iones de hidrógeno y bicarbonato) cuando se disuelven en agua.
Podemos clasificar los electrolitos en dos grupos diferentes: electrolitos fuertes y electrolitos débiles. Entre ellos, los electrolitos fuertes producen fácilmente iones cuando son solubles. Por ejemplo, los compuestos iónicos son electrolitos fuertes. El cloruro de sodio fundido o las soluciones de NaCl acuosa experimentan una disociación completa (en Na+ y Cl-iones); Por lo tanto, son buenos conductores de electricidad. Los ácidos y las bases fuertes también son buenos electrolitos. Por otro lado, los electrolitos débiles producen pocos iones cuando son solubles en agua. Además, los ácidos débiles como el ácido acético y las bases débiles son electrolitos débiles.

Figura 01: conductividades de algunos electrolitos para condensadores electrolíticos
Los electrolitos también ocurren en el cuerpo. Necesitamos estos electrolitos para mantener el equilibrio iónico dentro de las células y los líquidos sanguíneos en un cuerpo sano. El equilibrio electrolítico es muy importante para mantener el equilibrio osmótico y la presión arterial dentro del cuerpo. Na+, K+y Ca2+son importantes en la transmisión del impulso nervioso y las contracciones musculares.
¿Qué es la electrólisis??
La electrólisis es el proceso de usar una corriente eléctrica directa para impulsar una reacción química no espontánea. La electrólisis se puede realizar utilizando una célula electrolítica. Esta técnica es muy importante para separar un compuesto en sus iones u otros componentes.
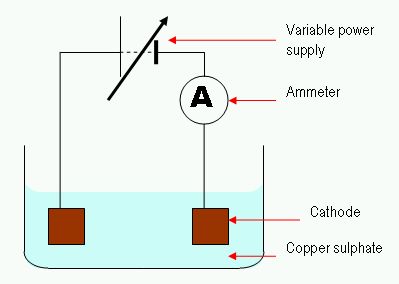
Figura 02: El proceso de electrólisis simple
En el proceso de electrólisis, una corriente eléctrica pasa a través de una solución para la movilidad de los iones en esa solución. Típicamente, una célula electrolítica consta de dos electrodos sumergidos en la misma solución. Llamamos a esta solución el electrolito. Una característica importante en la regulación de la célula electrolítica es "sobre el potencial."Tenemos que proporcionar un voltaje más alto para llevar a cabo una reacción no espontánea. Aquí, también se puede usar un electrodo inerte para proporcionar la superficie para la reacción que ocurre.
Hay muchas aplicaciones útiles de electrólisis. Una aplicación común es la electrólisis del agua. Aquí, el agua es el electrolito. Luego, la reacción de la descomposición de las moléculas de agua en gases de hidrógeno y oxígeno se realiza utilizando la corriente eléctrica que se pasa a través del electrolito.
¿Cuál es la diferencia entre electrolito y electrólisis??
La diferencia clave entre el electrolito y la electrólisis es que el electrolito es una sustancia que puede producir iones, mientras que la electrólisis es un proceso en el que se utiliza una corriente eléctrica para impulsar una reacción química. En otras palabras, en un electrolito, la sustancia fundida o disuelta produce iones que pueden moverse en el estado líquido o en una solución acuosa, mientras que en la electrólisis, se produce la descomposición de un electrolito por una corriente eléctrica. Electrolitos y la electrólisis están relacionados entre sí de diferentes maneras. Por ejemplo, la electrólisis puede ocurrir en presencia de un electrolito.
Resumen -Electrolito versus electrólisis
Por lo tanto, la diferencia clave entre el electrolito y la electrólisis es que el electrolito es una sustancia que puede producir iones, mientras que la electrólisis es un proceso en el que se utiliza una corriente eléctrica para impulsar una reacción química. En otras palabras, los electrolitos son sustancias, mientras que la electrólisis es un proceso.
Referencia:
1. Helmenstine, Anne Marie. "Ejemplos de química: electrolitos fuertes y débiles."Thinkco, agosto. 6, 2019.
Imagen de cortesía:
1. "Conductividad electrolitos -electric" por ELCAP - Trabajo propio (CC0) a través de Commons Wikimedia
2. "Sulfato de cobre electrólisis" de Theresa Knott en Wikibooks inglés. - Transferido desde EN.wikibooks a los comunes. (CC BY-SA 3.0) a través de Commons Wikimedia


