¿Cuál es la diferencia entre la entalpía y la entalpía molar?
El Diferencia clave entre la entalpía y la entalpía molar es que la entalpía es el contenido de calor total de un sistema termodinámico, mientras que la entalpía molar es el calor total por lunar de reactivo en el sistema.
La entalpía de entalpía y molar son términos útiles en química física para la determinación del contenido de calor total en un sistema termodinámico. Podemos definir un sistema termodinámico como un cuerpo de materia o radiación que está confinada por las paredes que tienen ciertas permeabilidades que pueden separar este sistema de los alrededores.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la entalpía
3. ¿Qué es la entalpía molar?
4. Entalpía y entalpía molar en forma tabular
5. Resumen - Entalpía contra la entalpía molar
Que es la entalpía?
La entalpía de un sistema es una cantidad termodinámica equivalente al contenido de calor total de un sistema. Es igual a la energía interna del sistema más el producto de la presión y el volumen. Por lo tanto, es una propiedad termodinámica de un sistema.
La ecuación de la entalpía se da a continuación.
H = U +PV
En la ecuación anterior, h es la entalpía del sistema, u es la energía interna del sistema, p es la presión y v es el volumen. La entalpía de un sistema es la indicación de la capacidad de ese sistema para liberar calor (para hacer un trabajo no mecánico). La entalpía se denota por el símbolo h.

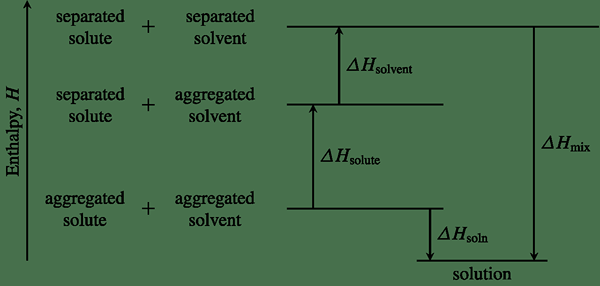
Figura 01: Un diagrama de entalpía que muestra los cambios de entalpía para una reacción química particular
Determinar la entalpía de un sistema nos permite indicar si una reacción química es exotérmica o endotérmica. El cambio en la entalpía de un sistema se puede usar para determinar el calor de las reacciones y para predecir si una reacción química es espontánea o no espontánea.
¿Qué es la entalpía molar??
La entalpía molar es el valor de entalpía dado por lunar. En esta definición, la entalpía es una cantidad termodinámica equivalente al contenido de calor total de un sistema. Es igual a la energía interna del sistema más el producto de la presión y el volumen. La unidad de medición para este valor es kj/mol. Por lo tanto, podemos derivar la ecuación para la determinación de la entalpía molar de la siguiente manera:
Entalpía molar = dh/n
Donde DH es el cambio en la entalpía del sistema, "n" es el número de moles de reactivo involucrado en el sistema. Por ejemplo, la entalpía molar para la formación de una sustancia particular es el cambio en la entalpía cuando se forma un mol de especies químicas en el estado estándar a una temperatura especificada. Esta formación de la sustancia ocurre a partir de la forma más estable de los elementos químicos constituyentes de esa sustancia en su estado estándar.
¿Cuál es la diferencia entre la entalpía y la entalpía molar??
La entalpía de entalpía y molar son términos útiles en química física para la determinación del contenido de calor total en un sistema termodinámico. La diferencia clave entre la entalpía y la entalpía molar es que la entalpía es el contenido de calor total de un sistema termodinámico, mientras que la entalpía molar es el calor total por lunar de reactivo en el sistema. Además, la unidad de medición para la entalpía es julios o kilojulios, mientras que la unidad de medición para la entalpía molar es kilojulios por lunar.
La siguiente tabla resume la diferencia entre la entalpía y la entalpía molar.
Resumen -Entalpía contra la entalpía molar
La entalpía de entalpía y molar son términos útiles que ayudan a determinar el contenido de calor total en un sistema termodinámico. La entalpía de un sistema es una cantidad termodinámica equivalente al contenido de calor total de un sistema. La entalpía molar es el valor de entalpía dado por lunar. Por lo tanto, la diferencia clave entre la entalpía y la entalpía molar es que la entalpía es el contenido de calor total de un sistema termodinámico, mientras que la entalpía molar es el calor total por lunar de reactivo en el sistema.
Referencia:
1. "Molar Antalpía." Una descripción general | Temas de ciencias, .
2. "¿Qué es la entalpía?? - Definición, reacción endotérmica y exotérmica."Byju's, 16 de noviembre. 2020.
3. "Entalpía." Bibliotecas de química, Libretexts, 15 de agosto. 2020.
Imagen de cortesía:
1. "Entalpía-diagrama-solución-formación-emocérmica" de Dale J. Brugh - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia