¿Cuál es la diferencia entre la ecuación del estado y el coeficiente de actividad?
El Diferencia clave entre la ecuación del estado y el coeficiente de actividad es que la ecuación de estado se puede aplicar tanto para las fases líquidas como de gas, mientras que el coeficiente de actividad se aplica solo para gases.
La ecuación del coeficiente de estado y de actividad son conceptos químicos importantes. La ecuación de estado puede definirse como una ecuación termodinámica relacionada con las variables de estado que describen el estado de la materia en ciertas condiciones físicas. El coeficiente de actividad es un factor útil en la termodinámica para la contabilidad de las desviaciones que proviene del comportamiento ideal en una mezcla de sustancias químicas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ecuación del estado?
3. ¿Qué es el coeficiente de actividad?
4. Ecuación de estado vs coeficiente de actividad en forma tabular
5. Resumen: ecuación de estado versus coeficiente de actividad
¿Qué es la ecuación del estado??
La ecuación de estado puede definirse como una ecuación termodinámica relacionada con las variables de estado que describen el estado de la materia en ciertas condiciones físicas. Las condiciones físicas que se pueden especificar incluyen presión, volumen, temperatura y energía interna. Esta ecuación es muy importante para explicar las propiedades de los fluidos, mezclas de fluidos, sólidos, etc.
No hay ecuaciones de estado que describan las propiedades de todas las sustancias con precisión en todas las condiciones. Por lo tanto, describimos las propiedades utilizando el estado ideal de las sustancias. Por ejemplo, la ley de gas ideal es un tipo de ecuación de estado. Esta ecuación es aproximadamente precisa para gases polares débiles cuando se consideran presiones bajas y temperaturas moderadas.
La forma general de la ecuación de estado se puede dar de la siguiente manera:
f (p, v, t) = 0
Aquí, P es una presión absoluta, v es volumen, y t es la temperatura absoluta. Ley de gas ideal clásica, ley de gas ideal cuántica, ecuaciones cúbicas de estado, ecuaciones de estado no cúcicas, ecuaciones viriales de estado, ecuaciones de estado de estado, ecuaciones multiparaméter de estado, etc., son algunos tipos de ecuaciones de estado.
¿Qué es el coeficiente de actividad??
El coeficiente de actividad es un factor utilizado en la termodinámica para la contabilidad de las desviaciones que provienen del comportamiento ideal en una mezcla de sustancias químicas. Al considerar una mezcla ideal, las interacciones microscópicas entre pares de especies químicas suelen ser similares. Por lo tanto, podemos expresar las propiedades de las mezclas directamente en términos de concentraciones simples o presiones parciales de las sustancias presentes. Un ejemplo de esto es la ley de Raoult. Podemos dar las desviaciones de la idealidad modificando la concentración utilizando un coeficiente de actividad. Lo opuesto al coeficiente de actividad es el coeficiente de fugacidad.

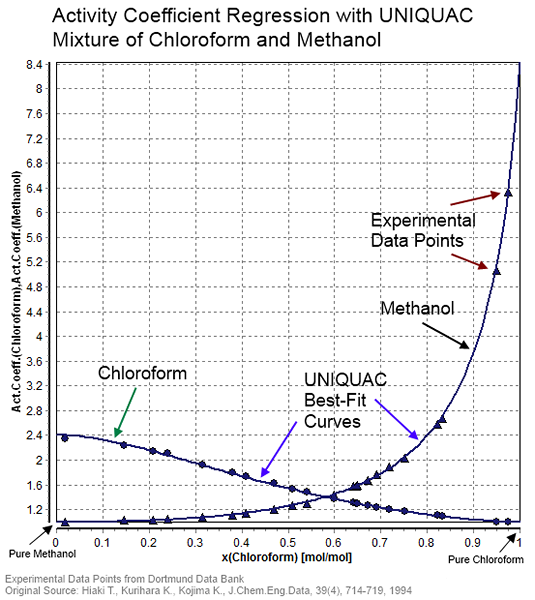
Figura 01: Coeficiente de actividad para una mezcla de cloroformo y metanol
Típicamente, podemos determinar el coeficiente de actividad a través de métodos experimentales. Esto se hace haciendo mediciones en mezclas no ideales. Los dos métodos principales son los métodos radioquímicos y el método de dilución infinita. Por ejemplo. Podemos obtener el coeficiente de actividad para mezclas binarias en la dilución infinita de cada componente.
¿Cuál es la diferencia entre la ecuación del estado y el coeficiente de actividad??
La ecuación del coeficiente de estado y de actividad son conceptos químicos importantes. La ecuación del estado es una ecuación termodinámica relacionada con las variables de estado que describen el estado de la materia en ciertas condiciones físicas, mientras que el coeficiente de actividad es un factor utilizado en la termodinámica para la contabilidad de las desviaciones que proviene del comportamiento ideal en una mezcla de sustancias químicas. La diferencia clave entre la ecuación del estado y el coeficiente de actividad es que la ecuación de estado se puede aplicar tanto para las fases líquidas como de gas, mientras que el coeficiente de actividad se aplica solo para gases. Además, la ecuación de estado es complicada de usar, mientras que el coeficiente de actividad es relativamente simple de usar.
La siguiente infografía enumera las diferencias entre la ecuación de estado y el coeficiente de actividad en forma tabular para la comparación de lado a lado.
Resumen: ecuación de estado versus coeficiente de actividad
La ecuación del coeficiente de estado y de actividad son conceptos químicos importantes. La diferencia clave entre la ecuación del estado y el coeficiente de actividad es que la ecuación de estado se puede aplicar tanto para las fases líquidas como de gas, mientras que el coeficiente de actividad se aplica solo para gases.
Referencia:
1. "Ecuación de estado." NASA.
Imagen de cortesía:
1. "Uniquac regresión cloroformo metanol" por wilfriedc - trabajo propio (cc by -sa 3.0) a través de Commons Wikimedia


