¿Cuál es la diferencia entre evaporación y cristalización?
El Diferencia clave entre evaporación y cristalización es que la evaporación es la formación de vapor a partir de un líquido, mientras que la cristalización es la formación de cristales sólidos de un líquido.
La evaporación y la cristalización son procesos físicos que son opuestos entre sí. La evaporación es el proceso físico de conversión de un líquido en su fase gaseosa a cierta temperatura alta. La cristalización es el proceso físico de la formación de cristales. Puede ocurrir como un proceso natural o como un proceso artificial.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la evaporación?
3. ¿Qué es la cristalización?
4. Evaporación vs cristalización en forma tabular
5. Resumen -Evaporación vs cristalización
¿Qué es la evaporación??
La evaporación es el proceso físico de conversión de un líquido en su fase gaseosa a cierta temperatura alta. Por lo general, está por debajo del punto de ebullición del líquido. Las moléculas en un líquido tienen valores diferentes para la energía cinética. Cuando proporcionamos energía del exterior al líquido (como el calor), aumenta la energía cinética de estas moléculas líquidas. Cuando la energía es suficiente para que las moléculas en la superficie superen las fuerzas intermoleculares entre ellas, las moléculas tienden a escapar de la superficie y se convierten en un estado de gas.

Figura 01: Evaporación
Sin embargo, algunas de las moléculas que ingresan a la fase gaseosa a través de la evaporación pueden unirse al líquido a través de la condensación. Esto constituye un equilibrio entre la tasa de evaporación y la tasa de condensación. Además, la presión constante de vapor se establece en esta etapa. Si aumentamos la temperatura del líquido en este punto, conduce a un aumento en la tasa de evaporación ya que la energía cinética de las moléculas aumenta. Por lo tanto, la cantidad de moléculas que ocupan el espacio por encima del líquido aumenta.
¿Qué es la cristalización??
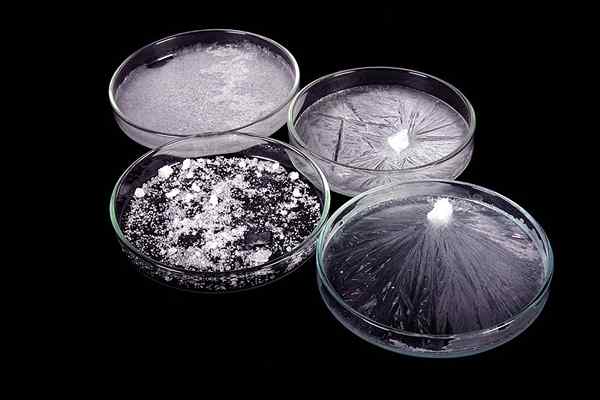
La cristalización es el proceso físico de formar cristales. Puede ocurrir como un proceso natural o como un proceso artificial. En la fase sólida de una sustancia, las moléculas o átomos están altamente organizados en una estructura cristalina. Llamamos a esto una estructura cristalina. Un cristal puede formarse de diferentes maneras, como la precipitación de una solución, congelación, deposición directamente de un gas (raramente), etc. El calor de la cristalización o la entalpía de la cristalización es la energía que cambia durante la cristalización de una sustancia.

Figura 02: Cristalización del acetato de sodio
Hay dos pasos principales de cristalización: nucleación (una fase cristalina aparece en un líquido superenfriado o en un disolvente supersaturado) y el crecimiento de los cristales o el crecimiento de partículas (el aumento del tamaño de las partículas y conduce a un estado de cristal).
¿Cuál es la diferencia entre evaporación y cristalización??
La evaporación y la cristalización son procesos físicos que son opuestos entre sí. La diferencia clave entre la evaporación y la cristalización es que la evaporación es la formación de vapor a partir de un líquido, mientras que la cristalización es la formación de cristales sólidos de un líquido. Además, la evaporación puede eliminar una sustancia más volátil de una mezcla líquida, mientras que la cristalización puede eliminar un sólido de un líquido.
La siguiente infografía enumera las diferencias entre la evaporación y la cristalización en forma tabular para la comparación de lado a lado.
Resumen -Evaporación vs cristalización
La evaporación y la cristalización son procesos físicos que son opuestos entre sí. La evaporación es la conversión de un líquido en su fase gaseosa a cierta temperatura alta. La cristalización es la formación de cristales y puede ocurrir como un proceso natural o como un proceso artificial. La diferencia clave entre la evaporación y la cristalización es que la evaporación es la formación de vapor a partir de un líquido, mientras que la cristalización es la formación de cristales sólidos de un líquido.
Referencia:
1. "Evaporación." Sociedad Nacional Geográfica, 8 de agosto. 2019.
Imagen de cortesía:
1. "Copa Watevapor" (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Kristalizacija" de Taki Jo - Trabajo propio (CC By -Sa 4.0) a través de Commons Wikimedia


