¿Cuál es la diferencia entre la transición de fase de primer y segundo orden?
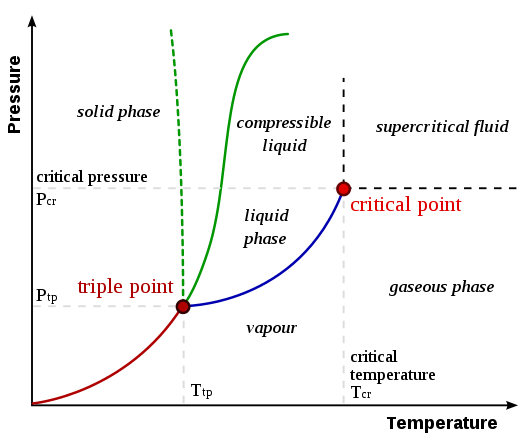
El diferencia clave entre la transición de fase de primer y segundo orden Es que las transiciones de fase de primer orden dependen de la primera potencia de la concentración del reactante en una ecuación de velocidad, mientras que las transiciones de fase de segundo orden dependen de la segunda potencia de la concentración en la ecuación de velocidad.
Una transición de fase es un cambio de fase de la materia, que es un proceso físico de transición de un estado de medio a un estado diferente del mismo medio, que se identifica por parámetros como la densidad y el volumen. En general, este término se usa para describir fases como sólido, líquido, gas y plasma. Los tipos de transiciones de fase incluyen fusión, ebullición, sublimación, vaporización, ionización, deposición, condensación y recombinación.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la transición de fase de primer orden?
3. ¿Qué es la transición de fase de segundo orden?
4. Primera transición de fase de segundo orden en forma tabular
5. Resumen -Primera transición de fase de segundo orden
¿Qué es la transición de fase de primer orden??
Las transiciones de fase de primer orden son reacciones químicas en las que la velocidad de reacción depende de la concentración molar de uno de los reactivos involucrados en la reacción. Por lo tanto, la suma de los poderes a los que se elevan las concentraciones de reactivos en la ecuación de la ley de tasa siempre será 1. Si un solo reactivo participa en estas reacciones, la concentración de ese reactante determina la velocidad de la reacción. Pero a veces, hay más de un reactivo que participa en estas reacciones. En tales casos, uno de estos reactivos determinará la velocidad de la reacción.

Podemos caracterizar una transición de fase de primer orden por la discontinuidad de las variables termodinámicas, incluida la densidad y la entropía. Además, este tipo de transición generalmente se muestra mediante cambios en el volumen.
¿Qué es la transición de fase de segundo orden??
Las transiciones de fase de segundo orden son reacciones químicas en las que la velocidad de reacción depende de la concentración molar de dos de los reactivos o la segunda potencia de un reactante involucrado en la reacción. Por lo tanto, la suma de los poderes a los que se elevan las concentraciones de reactivos en la ecuación de la ley de tasas siempre será 2. Si hay dos reactivos, la velocidad de reacción dependerá de la primera potencia de la concentración de cada reactivo.
Una transición de segunda fase también se conoce como una transición de fase continua porque se caracteriza por una susceptibilidad divergente, una decadencia de ley de poder de correlaciones cerca de la criticidad, etc. La teoría detrás de las transiciones de fase de segundo orden fue desarrollada por científicos utilizando la teoría de Landau.
¿Cuál es la diferencia entre la transición de fase de primer y segundo orden??
Las reacciones de primer orden y segundo orden pueden ocurrir como transiciones de fase. La diferencia clave entre la transición de fase de primer y segundo orden es que las transiciones de fase de primer orden dependen de la primera potencia de la concentración del reactante en una ecuación de velocidad, mientras que las transiciones de fase de segundo orden dependen de la segunda potencia de la concentración en la ecuación de velocidad.
A continuación se muestra un resumen de la diferencia entre la transición de fase de primer y segundo orden en forma tabular para la comparación de lado a lado.
Resumen -Primera transición de fase de segundo orden
Las transiciones de fase de primer orden son reacciones químicas en las que la velocidad de reacción depende de la concentración molar de uno de los reactivos involucrados en la reacción. Las reacciones de segundo orden, por otro lado, son reacciones químicas en las que la velocidad de reacción depende de la concentración molar de dos de los reactivos o la segunda potencia de un reactante involucrado en la reacción. La diferencia clave entre la transición de fase de primer y segundo orden es que las transiciones de fase de primer orden dependen de la primera potencia de la concentración del reactante en una ecuación de velocidad, mientras que las transiciones de fase de segundo orden dependen de la segunda potencia de la concentración en la ecuación de velocidad.
Referencia:
1. "Transición de fase de orden." Una descripción general | Temas de ciencias.
Imagen de cortesía:
1. "Phase-DiaG2" de Matthieumarechal (CC BY-SA 3.0) a través de Commons Wikimedia


