¿Cuál es la diferencia entre el calor de la solución y el calor de la reacción?
El Diferencia clave entre el calor de la solución y el calor de la reacción Es que el calor de la solución es la cantidad de energía térmica liberada o absorbida por un sistema químico tras la formación de una solución, mientras que el calor de reacción es la diferencia entre las entalpías molares de productos totales y el reactivo total que se calculan para sustancias químicas en el estado estándar.
El calor de la solución y el calor de reacción son valores importantes de entalpía en química física que son útiles en la determinación de las propiedades de las soluciones y las reacciones químicas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el calor de la solución?
3. ¿Qué es el calor de la reacción?
4. Calor de solución frente al calor de reacción en forma tabular
5. Resumen: calor de solución frente al calor de reacción
¿Qué es el calor de la solución??
El calor de la solución o la entalpía de la solución es la cantidad de energía térmica liberada o absorbida por un sistema químico tras la formación de una solución. Este valor de entalpía está relacionado con la disolución de una sustancia en un solvente que está en constante presión, lo que resulta en una dilución infinita.
La mayoría de las veces, el calor de la solución se da para una temperatura constante en KJ/Mol. Hay tres partes de este cambio de energía: la descomposición endotérmica de los enlaces químicos que existen en el disolvente, la descomposición de los enlaces químicos dentro del soluto y la formación de fuerzas de atracción entre el soluto y el solvente. Además, podemos decir que una solución ideal generalmente contiene una entalpía nula de mezcla, mientras que una solución no ideal tiene un exceso de cantidad molar.
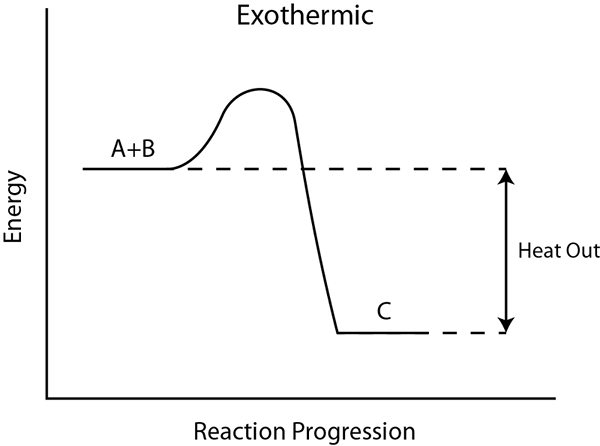
Al considerar la mayoría de los gases, la disolución es exotérmica. Cuando un gas se disuelve en un líquido, la energía se libera como calor al calentar tanto la solución como los alrededores. La temperatura de la solución tiende a disminuir eventualmente, coincidiendo con la temperatura de los alrededores. Además, si calentamos una solución saturada de un gas, el gas tiende a salir de la solución.
¿Qué es el calor de la reacción??
El calor de la entalpía de reacción o reacción es la diferencia entre las entalpías molares de productos totales y el reactivo total que se calculan para sustancias químicas en el estado estándar. Este valor de entalpía es útil para predecir la energía total del enlace químico que se libera o se une durante la reacción química. Aquí, debemos dar cuenta de la entalpía de la mezcla también.
En la determinación del calor de reacción, el estado estándar se puede definir para cualquier valor de temperatura y presión, y el valor debe especificarse para esa temperatura y presión particular, pero los valores generalmente se dan a 25 grados Celsius temperatura y presión de 1 atmm.

Al considerar los iones en una solución acuosa, podemos elegir el estado estándar, considerando que la concentración acuosa de iones H+ de exactamente 1 mol/L tiene una entalpía de formación estándar cero. Esto hace posible tabular las entalpías estándar para cationes y aniones a una concentración estándar similar.
¿Cuál es la diferencia entre el calor de la solución y el calor de la reacción??
El calor de la solución y el calor de reacción son valores de entalpía importantes en la química física que son útiles en la determinación de las propiedades de las soluciones y las reacciones químicas. La diferencia clave entre el calor de la solución y el calor de reacción es que el calor de la solución es la cantidad de energía térmica liberada o absorbida por un sistema químico tras la formación de una solución, mientras que el calor de reacción es la diferencia entre las entalpías de molares de productos totales y el reactivo total que se calculan para sustancias químicas en el estado estándar.
La siguiente infografía enumera las diferencias entre el calor de la solución y el calor de reacción en forma tabular para la comparación de lado a lado.
Resumen: calor de solución frente al calor de reacción
El calor de la solución y el calor de reacción son valores importantes de entalpía en química física que son útiles en la determinación de las propiedades de las soluciones y las reacciones químicas. La diferencia clave entre el calor de la solución y el calor de reacción es que el calor de la solución es la cantidad de energía térmica liberada o absorbida por un sistema químico tras la formación de una solución, mientras que el calor de reacción es la diferencia entre las entalpías de molares de productos totales y el reactivo total que se calculan para sustancias químicas en el estado estándar.
Referencia:
1. “Fórmula de calor de reacción - definición, ecuación y ejemplos resueltos."Byju's, 15 de septiembre. 2020.
Imagen de cortesía:
1. "Reacción exotérmica" por BrazoSport College - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia


