¿Cuál es la diferencia entre la homólisis y la heterólisis?
El Diferencia clave entre la homólisis y la heterólisis es que la homólisis es la descomposición de un compuesto químico en dos partes químicamente iguales, mientras que la heterólisis es la descomposición de un compuesto químico en dos partes químicamente diferentes.
Podemos usar energías de disociación de enlaces de compuestos químicos para describir los procesos de homólisis y heterólisis. La energía de disociación del enlace es una medida de la resistencia de un enlace químico. Un enlace puede disociarse de manera homolítica o de manera heterolítica. La energía de disociación del enlace se define como el cambio de entalpía estándar cuando un enlace químico se escinde mediante homólisis.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la homólisis?
3. ¿Qué es la heterólisis?
5. Homólisis vs heterólisis en forma tabular
6. Resumen
¿Qué es la homólisis??
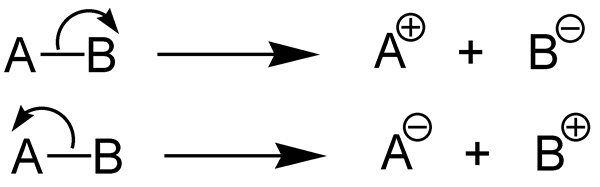
La homólisis es la escisión de un enlace químico de una manera que da dos partes químicamente iguales del compuesto químico. Un enlace químico (enlace covalente) contiene dos electrones. En esta forma de fisión, cada uno de los fragmentos obtiene un electrón no apartado. Cuando esta disociación de enlace ocurre en una molécula neutra que tiene un número par de electrones, forma dos radicales libres iguales.

Figura 01: Mecanismo general de fisión homolítica
El enlace homolítico La energía de disociación es la cantidad de energía requerida para disociar un enlace químico a través de la hemólisis. La hemólisis de un enlace químico es la escisión simétrica de los dos radicales que forman el enlace, no dos iones. Aquí, los electrones de enlace entre los átomos se dividen en dos mitades y son tomados por los dos átomos. Por ejemplo, la escisión homolítica de un enlace sigma forma dos radicales que tienen un electrón no apareado por radical.
¿Qué es la heterólisis??
La heterólisis es la escisión de un enlace químico de una manera que proporciona dos partes químicamente diferentes del compuesto químico. La fisión heterolítica es la disociación de un enlace químico y forman dos fragmentos desiguales. Un enlace químico (enlace covalente) contiene dos electrones. En esta forma de fisión, un fragmento obtiene ambos pares de electrones de unión, mientras que el otro fragmento no tiene electrones de enlace.

Figura 02: Dos tipos de fisuras heterolíticas
La energía de disociación del enlace heterolítico es la cantidad de energía requerida para clavar un enlace químico a través de la heterólisis. La heterólisis es la escisión de un enlace químico de manera asimétrica. La heterólisis forma cationes y aniones ya que, en la heterólisis, el par de electrones de enlace es tomado por el átomo electronegativo (se convierte en el anión), mientras que el otro átomo no toma electrones (forma el catión).
¿Cuál es la diferencia entre la homólisis y la heterólisis??
La homólisis y la heterólisis son procesos químicos que son opuestos entre sí. La diferencia clave entre la homólisis y la heterólisis es que la homólisis es la descomposición de un compuesto químico en dos partes químicamente iguales, mientras que la heterólisis es la descomposición de un compuesto químico en dos partes químicamente diferentes. Además, la energía de disociación del enlace homolítico determina la energía requerida para que ocurra la homólisis, mientras que la energía de disociación del enlace heterolítico determina la energía requerida para que ocurra la heterólisis.
La siguiente infografía resume la diferencia entre la homólisis y la heterólisis en forma tabular.
Resumen -Homólisis vs heterólisis
La homólisis y la heterólisis son procesos químicos que son opuestos entre sí. La diferencia clave entre la homólisis y la heterólisis es que la homólisis es la descomposición de un compuesto químico en dos partes químicamente iguales, mientras que la heterólisis es la descomposición de un compuesto químico en dos partes químicamente diferentes.
Referencia:
1."Homólisis." Una descripción general | Temas de ciencias.
Imagen de cortesía:
1. "Homólisis (química)" de Jürgen Martens - Jürgen Martens (dominio público) a través de Commons Wikimedia
2. "Heterólisis (Química)" de Jürgen Martens - Jürgen Martens (CC By -SA 3.0) a través de Commons Wikimedia


