¿Cuál es la diferencia entre el equilibrio iónico y el equilibrio químico?
El Diferencia clave entre el equilibrio iónico y el equilibrio químico es que el equilibrio iónico ocurre entre las moléculas y los iones sindicalizados en un electrolito, mientras que el equilibrio químico ocurre entre reactivos y productos químicos.
El equilibrio iónico y químico son fenómenos importantes en la química. El equilibrio iónico es el equilibrio que se establece entre las moléculas sindicalizadas y los iones en una solución de electrolitos débiles. El equilibrio químico es el estado en el que tanto los reactivos como los productos están presentes en concentraciones que no tienen más tendencia a cambiar con el tiempo.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el equilibrio iónico?
3. ¿Qué es el equilibrio químico?
4. Equilibrio iónico versus equilibrio químico en forma tabular
5. Resumen - equilibrio iónico versus equilibrio químico
¿Qué es el equilibrio iónico??
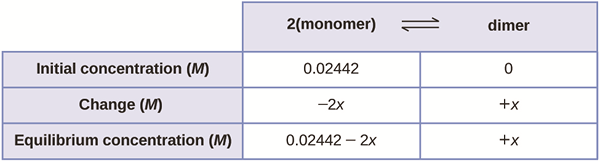
El equilibrio iónico puede describirse como el equilibrio establecido entre las moléculas sindicalizadas y los iones en una solución de electrolitos débiles. En general, el pH mide la acidez o alcalinidad de una solución. Esto se debe a que los ácidos tienden a liberar iones de hidrógeno en la solución. Si se disuelve una sal con escasamente soluble en agua, se crea un equilibrio iónico.
El equilibrio iónico también es un tipo de equilibrio donde las cantidades de productos y reactivos no cambian con el tiempo. Sin embargo, esto no significa que la reacción se haya detenido; Más bien, la reacción avanza de una manera que mantiene las cantidades sin cambios (el cambio neto es cero).
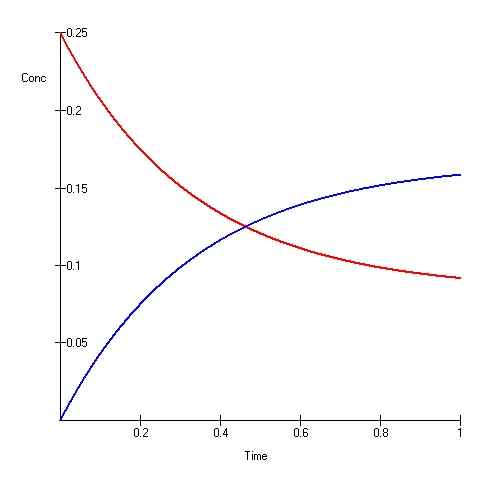
El equilibrio iónico también se conoce como un "equilibrio dinámico."En este tipo de equilibrio, la reacción es reversible y continua. Para que se realice un equilibrio dinámico, el sistema debe estar cerrado para que ninguna energía o materia escape del sistema.
¿Qué es el equilibrio químico??
El equilibrio químico se puede describir como el estado en el que tanto los reactivos como los productos están presentes en concentraciones que no tienen más tendencia a cambiar con el tiempo. Algunas reacciones son reversibles, y algunas reacciones son irreversibles. En una reacción, los reactivos se convierten a productos. En algunas reacciones, los reactivos se generan nuevamente a partir de los productos. Por lo tanto, este tipo de reacción es reversible.
En reacciones irreversibles, una vez que los reactivos se convierten en productos, no se regeneran nuevamente de los productos. En una reacción reversible, cuando los reactivos van a los productos, lo llamamos una reacción hacia adelante, y cuando los productos van a reactivos, es una reacción hacia atrás.

Cuando la velocidad de reacciones hacia adelante y hacia atrás es igual, entonces la reacción está en equilibrio. Por lo tanto, durante algún tiempo, la cantidad de reactivos y productos no cambia. Las reacciones reversibles siempre tienden a llegar al equilibrio y mantienen ese equilibrio. Cuando el sistema está en un equilibrio, la cantidad de productos y los reactivos no son necesariamente iguales. Puede haber una mayor cantidad de reactivos que los productos o viceversa. El único requisito en una ecuación de equilibrio es el mantenimiento de una cantidad constante de ambos con el tiempo. Para una reacción en equilibrio, podemos definir una constante de equilibrio como: donde es igual a la relación entre la concentración de productos y la concentración de reacciones.
Para una reacción de equilibrio, si la reacción directa es exotérmica, entonces la reacción hacia atrás es endotérmica y viceversa. Normalmente, todos los demás parámetros para reacciones hacia adelante y hacia atrás son opuestas entre sí como esta. Por lo tanto, si queremos facilitar cualquiera de las reacciones, simplemente tenemos que ajustar los parámetros para facilitar esa reacción.
¿Cuál es la diferencia entre el equilibrio iónico y el equilibrio químico??
El equilibrio iónico y químico son fenómenos importantes en la química. La diferencia clave entre el equilibrio iónico y el equilibrio químico es que el equilibrio iónico ocurre entre las moléculas y los iones sindicalizados en un electrolito, mientras que el equilibrio químico ocurre entre reactivos químicos y productos.
La siguiente infografía presenta las diferencias entre el equilibrio iónico y el equilibrio químico en forma tabular para la comparación de lado a lado.
Resumen -equilibrio iónico versus equilibrio químico
El equilibrio iónico es el equilibrio que se establece entre las moléculas sindicalizadas y los iones en una solución de electrolitos débiles. El equilibrio químico es el estado en el que tanto los reactivos como los productos están presentes en concentraciones que no tienen más tendencia a cambiar con el tiempo. La diferencia clave entre el equilibrio iónico y el equilibrio químico es que el equilibrio iónico ocurre entre las moléculas y los iones sindicalizados en un electrolito, mientras que el equilibrio químico ocurre entre reactivos químicos y productos.
Referencia:
1. "Introducción, tipos y función del equilibrio iónico." Kullabs.
Imagen de cortesía:
1. "CNX Chem 13 04 ICETABLE25 IMG" por OpenStax - (CC por 4.0) a través de Commons Wikimedia
2. "Equilibrio químico" por V8RIK en la Wikipedia en inglés (CC By-SA 3.0) a través de Commons Wikimedia


