¿Cuál es la diferencia entre las especies isotónicas e isoelectrónicas?
El Diferencia clave entre las especies isotónicas e isoelectrónicas es que las especies isotónicas tienen un número similar de neutrones, mientras que las especies isoelectrónicas tienen un número similar de electrones.
Los términos isotónicos e isoelectrónicos se refieren a especies químicas que tienen algo en común, e.gramo., El mismo número de electrones, el mismo número de neutrones, etc.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las especies isotónicas?
3. ¿Qué son las especies isoelectrónicas?
4. Especies isotónicas vs isoelectrónicas en forma tabular
5. Resumen - Especies isotónicas vs isoelectrónicas
¿Qué son las especies isotónicas??
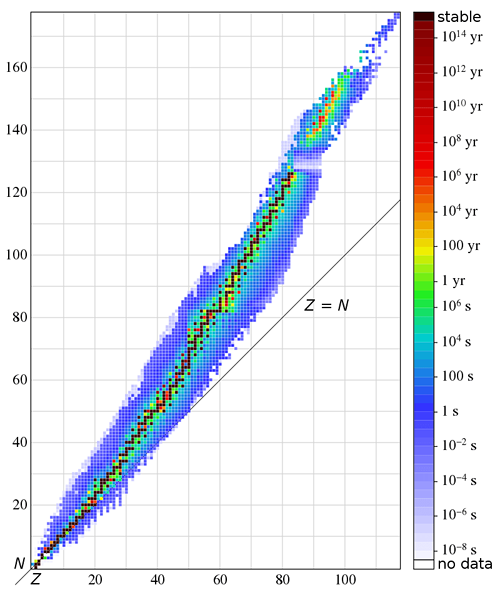
Las especies isotónicas son especies químicas que tienen un número idéntico de neutrones. Estos también se conocen como isotones. Los isotones son dos o más nucleidos con el mismo número de neutrones, pero tienen diferentes números de protones. El número de neutrones se denota por n, y el número de protones se denota por z.
Un ejemplo común sería el boro -12 y el carbono - 13 núcleos. Botle estos nucleidos contienen 7 neutrones en cada átomo. Por lo tanto, podemos nombrarlos como isotones. Un grupo similar de especies isotónicas incluye átomos con 20 neutrones por átomo. Este grupo incluye S-36, CL-37, AR-38, K-39 y CA-40. Todos estos átomos tienen 20 neutrones pero diferentes números de protones. Podemos obtener el número de protones deduciendo 20 del número de masa. mi.gramo., Para el átomo de azufre, el número de protones por átomo = 36 - 20 = 16.

El término isotónico proviene del griego que significa "el mismo estiramiento."Fue introducido por el físico alemán K.Guggenheimer. Puede haber muchos átomos con el mismo número de neutrones al considerar los isótopos de los elementos químicos. Típicamente, el mayor número de nucleidos observacionalmente estables sale para dos especies isotónicas 50 y 82.
¿Qué son las especies isoelectrónicas??
Las especies isoelectrónicas son especies químicas que tienen un número idéntico de electrones. En otras palabras, las especies isoelectrónicas tienen el mismo número de electrones o la misma estructura electrónica. Este fenómeno se conoce como isoelectonicity.
Por ejemplo, el monóxido de carbono, NO+y N2 son especies químicas isoelectrónicas porque estas estructuras tienen el mismo número de electrones por compuesto. En contraste, CH3COOH y CH3N = NCH3 no son isoelectrónicos porque tienen un número diferente de electrones.

La importancia de identificar las especies químicas isoelectrónicas es la capacidad de estudiar especies significativamente relacionadas como parejas o series. Además, podemos esperar que esto sea útil en la consistencia y la previsibilidad de las propiedades de estas especies químicas. Por lo tanto, nos proporciona pistas sobre las posibles propiedades y reacciones.
Por ejemplo, el átomo de N y el ion O+ son isoelectrónicos entre sí. Esto se debe a que ambas especies tienen cinco electrones de valencia y el [He] 222p3. Otro ejemplo común es la serie de cationes con K+, Ca2+y SC3+. Del mismo modo, Cl-, S2- y P3- es una serie de aniones con un número similar de electrones.
En las moléculas diatómicas, podemos usar diagramas orbitales moleculares para ilustrar la isoelectonicidad en una molécula diatómica. Esto muestra orbitales atómicos que se mezclan en especies isoelectrónicas, lo que indica la combinación orbital idéntica, así como la unión.
Hay algunos compuestos poliatómicos que pueden ser isoelectrónicos entre sí. Un ejemplo comúnmente conocido sería la serie de aminoácidos con serina, cisteína y selenocisteína. Estos aminoácidos son diferentes entre sí de acuerdo con el calcógeno específico que está presente en una ubicación en la cadena lateral.
¿Cuál es la diferencia entre las especies isotónicas e isoelectrónicas??
Las especies químicas isotónicas e isoelectrónicas son importantes para estudiar las propiedades químicas de los compuestos relacionados. La diferencia clave entre las especies isotónicas e isoelectrónicas es que en las especies isotónicas, el número de neutrones es el mismo, mientras que, en las especies isoelectrónicas, el número de electrones es el mismo.
La siguiente infografía presenta las diferencias entre las especies isotónicas e isoelectrónicas en forma tabular para la comparación de lado a lado.
Resumen -Especies isotónicas vs isoelectrónicas
Las especies isotónicas son especies químicas que tienen un número idéntico de neutrones. Las especies isoelectrónicas son especies químicas que tienen un número idéntico de electrones. Por lo tanto, la diferencia clave entre las especies isotónicas e isoelectrónicas es que las especies isotónicas tienen un número similar de neutrones, mientras que las especies isoelectrónicas tienen un número similar de electrones.
Referencia:
1. "¿Cuál de las siguientes especies es isotónica con 37 RB 86 ?" Tardígrado, 30 de octubre. 2019.
Imagen de cortesía:
1. "Isótopos y vida media" de Benrg - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Monóxido de carbono Simple" de Yikrazuul (charla) - Trabajo propio (dominio público) a través de Commons Wikimedia
3. "Nitrosonium-2D-Dimensions" (dominio público) a través de Commons Wikimedia


